Tiere leben in einer engen und lebenslangen Partnerschaft mit unzähligen Mikroorganismen, die zusammen als Mikrobiota bezeichnet werden. Es hat sich gezeigt, dass diese symbiotischen Mikroben die Ernährung und den Stoffwechsel regulieren und für die Entwicklung und Funktion des Immunsystems unerlässlich sind. Neuere Studien deuten sogar darauf hin, dass die Darmbakterien neurologische Prozesse beeinflussen können – sie verändern das Verhalten und beeinflussen möglicherweise den Beginn und/oder die Schwere von Erkrankungen des Nervensystems. In diesem Artikel beleuchten wir die neuesten Erkenntnisse darüber, dass das Mikrobiom seinen Einfluss auf das Gehirn über verschiedene Wege ausübt, die den Darm mit dem zentralen Nervensystem verbinden. Das Verständnis für die Auswirkungen der Darmflora auf die neurologische Funktion steckt zwar noch in den Kinderschuhen, doch die Entschlüsselung der Verbindungen zwischen Darm, Mikrobiom und Gehirn verspricht, die Neurowissenschaften zu revolutionieren und potenziell neue Ursachen für psychiatrische und neurodegenerative Erkrankungen aufzudecken.
Metazoen entwickelten sich in einer Welt, die vom mikrobiellen Leben dominiert wird. Trotz der langen Evolutionsgeschichte, die über viele Jahrtausende hinweg komplexe Wirt-Mikroben-Symbiosen hervorgebracht hat, hat die Wissenschaft und die Gesellschaft erst vor kurzem begonnen, die untrennbare Verbindung zwischen Mikroben und Säugetieren zu erkennen. Wir erleben eine Flut von Forschungsergebnissen, die beschreiben und definieren, wie Darmbakterien (die sogenannte Mikrobiota) wichtige Aspekte unserer Physiologie beeinflussen. Das letzte Jahrzehnt der Forschung hat zahlreiche komplexe Interaktionen zwischen der Mikrobiota und dem Immun- und Stoffwechselsystem aufgezeigt, von denen viele erhebliche Auswirkungen auf die menschliche Gesundheit haben. Während die faszinierenden und tiefgreifenden Mechanismen, mit denen Darmbakterien die Immunität und den Stoffwechsel kontrollieren, zu einer modernen Renaissance in der biomedizinischen Forschung geführt haben, ist die Regulierung des Nervensystems durch die Mikrobiota erst vor kurzem relativ wenig erforscht worden. Wie könnten einfache Darmmikroben ein komplexes und entferntes Organ wie das Gehirn beeinflussen? Dieses scheinbar unwahrscheinliche Konzept, dass bestimmte Mikroben das Verhalten und die neurologische Funktion ihrer Wirte beeinflussen, war in der Tat bereits etabliert. Ein Paradebeispiel für “mikrobielle Gedankenkontrolle” ist die Entwicklung von Aggression und Hydrophobie bei Säugetieren, die mit dem Tollwutvirus infiziert sind. Ein weiteres bekanntes Beispiel für Verhaltensänderungen ist Toxoplasma gondii, das die Angstreaktion der Wirtsnagetiere verändert. Infizierte Nagetiere verlieren ihr Abwehrverhalten in Gegenwart von Katzen als Fressfeinden und fühlen sich stattdessen sexuell von Katzengerüchen angezogen. Dies führt dazu, dass infizierte Nagetiere leichter von Katzen gejagt werden und Toxoplasma seinen Lebenszyklus im Katzenwirt fortsetzen kann. Darüber hinaus sind verschiedene parasitäre Mikroben in der Lage, das Bewegungsverhalten und die Umweltpräferenzen ihrer Wirte zum Vorteil der Mikrobe zu verändern. Der Parasit Spinochordodes tellinii beispielsweise bewirkt, dass infizierte Heuschrecken nicht nur häufiger springen, sondern auch eine aquatische Umgebung aufsuchen, in der der Parasit zum Zweck der Paarung und Eierproduktion auftaucht. Auch die Temperaturpräferenz des Wirts kann verändert werden, wie z. B. bei der Infektion von Stichlingen mit Schistocephalus solidus, die die Präferenz des Wirts von kühlerem zu wärmerem Wasser verändert, wo der Parasit leichter wachsen kann. Andere Mikroben können sogar das Verhalten des Wirts verändern, so dass er höhere Lagen aufsucht, vermutlich damit der infizierte Wirt von Fressfeinden leichter bemerkt wird oder schließlich herunterfällt und sich auf darunter befindliche, empfängliche Wirte verteilt. Noch zwanghafter können Mikroben das Sozialverhalten ihrer Wirte beeinflussen und Insekten, wie z. B. Ameisen, zum Vorteil des Parasiten mehr oder weniger sozial machen. Tatsächlich bewirkt das sexuell übertragbare Virus IIV-6/CrIV, dass der Grillenwirt (Gryllus texensis) sein Paarungsverlangen verstärkt, was zu einer deutlichen Erhöhung seiner Paarungsrate und zur Übertragung zwischen einzelnen Wirten führt.
All diese Beispiele stellen zwar mit Sicherheit pathogene und/oder parasitäre Beziehungen dar, werfen aber dennoch die Frage auf, ob die einheimischen Mikroben, die in ständiger, lebenslanger Wechselwirkung mit ihren menschlichen und tierischen Wirten stehen, die neurologische Funktion und das Verhalten während der Entwicklung oder im Gesundheits- und Krankheitszustand beeinflussen könnten. Es wird zunehmend erkannt, dass psychiatrische und neurologische Erkrankungen häufig mit gastrointestinalen (GI) Pathologien einhergehen, darunter Schizophrenie, Autismus, neurodegenerative Erkrankungen und Depressionen. Darüber hinaus haben neuere Beobachtungen gezeigt, dass die kommensale Mikrobiota des Darms tatsächlich Aspekte der neurologischen Funktion ihrer Wirte verändern, was zu Auswirkungen auf Stimmung und Verhalten führt, einschließlich Depressionen, Angstzuständen, Sozialverhalten und Partnerwahl (Tabelle 1). Es ist jedoch allgemein bekannt, dass die Darmmikrobiota einen tiefgreifenden Einfluss auf die Gestaltung des Immunsystems des Wirts hat, was wiederum das Verhalten des Wirts beeinflussen kann, und indirekt Auswirkungen auf die Neurodegeneration und -reparatur während des Alterungsprozesses, neurologischer Traumata und Krankheiten hat. Die genauen Mechanismen, wie die Darmmikroben die neurologische Funktion und das Verhalten beeinflussen, sind weitgehend unbekannt, aber wahrscheinlich vielfältig, unterschiedlich und komplex.
Interaktionen zwischen einem Wirt und dem Mikrobiom sind ausgesprochen kompliziert. Die Darmmikrobiota beeinflusst zahlreiche Aspekte des Stoffwechsels, indem sie metabolische Vorläufer von Hormonen und Neurotransmittern produziert oder direkt die aktiven Metaboliten selbst herstellt. Symbiotische Bakterien haben zusätzlich die Fähigkeit, den Status des systemischen Immunsystems zu beeinflussen, was verändern kann, wie das Immunsystem anschließend mit dem Nervensystem interagiert. Darüber hinaus ist das enterische Nervensystem (ENS) über den Vagusnerv direkt mit dem zentralen Nervensystem (ZNS) verbunden, was einen direkten neurochemischen Weg für die Ausbreitung von mikrobiell geförderten Signalen im GI-Trakt zum Gehirn darstellt. Im Folgenden geben wir einen Überblick über das aktuelle Verständnis davon, wie die Darmmikrobiota das Verhalten und die neurologische Funktion während Gesundheit und Krankheit beeinflusst. Zunächst werden wir uns darauf konzentrieren, wie einheimische Mikroben die Stimmung und das kognitive Verhalten sowie das Sozialverhalten prägen. Als Nächstes werden wir die physiologischen Aspekte erörtern, die durch von der Mikrobiota abgeleitete Signale moduliert werden. Insbesondere werden wir uns darauf konzentrieren, wie die kommensalen Mikroben direkt und indirekt neurochemische und immunologische Reaktionen prägen, die anschließend Verhaltensweisen und andere neurologische Funktionen beeinflussen können (Tabelle 1). Angesichts der gut dokumentierten Beweise dafür, dass die Mikrobiota die Immunität und den Stoffwechsel prägt, stellt die Auswirkung der Darmmikroben auf das Nervensystem eine aufregende neue Forschungsfront mit enormen translationalen Implikationen dar.
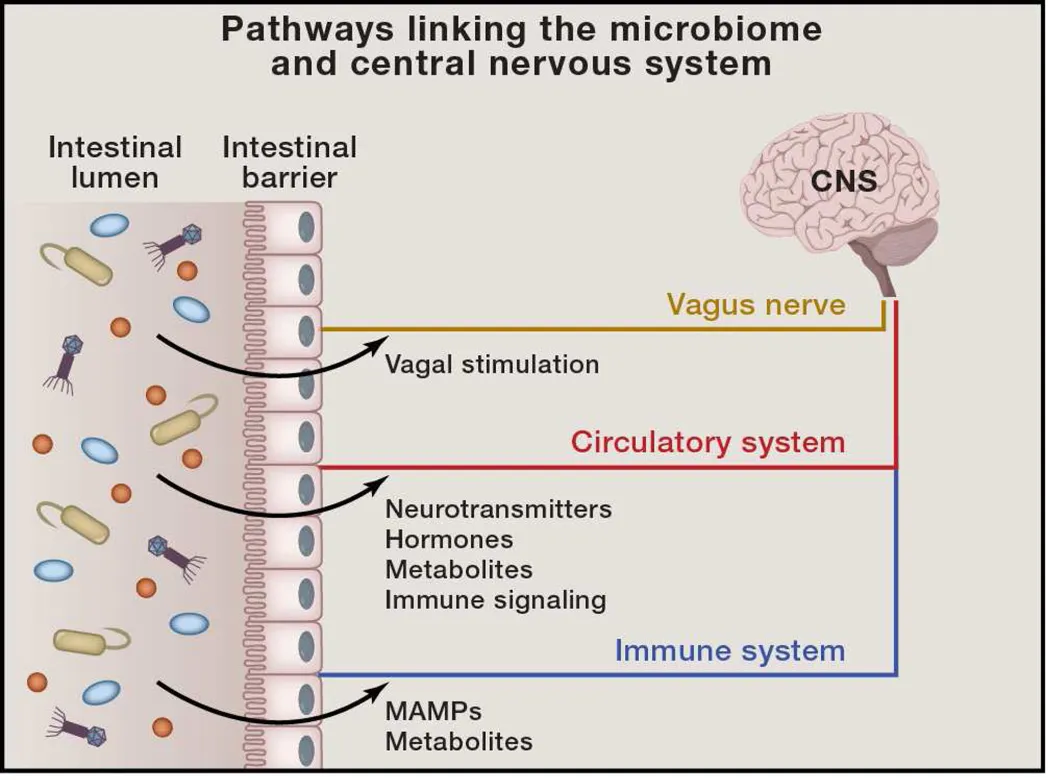 Wege, die das Mikrobiom und das zentrale Nervensystem verbinden
Wege, die das Mikrobiom und das zentrale Nervensystem verbinden
Signale aus dem intestinalen Mikrobiom können potenziell über verschiedene Mechanismen zum zentralen Nervensystem (ZNS) gelangen. 1) Direkte Aktivierung des Vagusnervs vom enterischen Nervensystem zum ZNS. 2) Produktion oder Induktion verschiedener Metaboliten, die die Darmbarriere passieren und in den Kreislauf gelangen, wo sie die Blut-Hirn-Schranke überwinden können, um die neurologische Funktion zu regulieren. 3) Mikrobielle assoziierte molekulare Muster (MAMPs, wie LPS, BLP und PSA) und Metaboliten, die vom Mikrobiom produziert werden, können dem Immunsystem signalisieren. Immunzellen (und insbesondere ihre Zytokine) können die Neurophysiologie beeinflussen.
Rolle der Mikrobiota bei Stimmung und individuellem Verhalten
Eine der bahnbrechenden Studien über den Einfluss der kommensalen Mikrobiota auf die neurologische Funktion beobachtete, dass keimfreie (GF) Mäuse eine erhöhte Reaktion auf Restraint-Stress zeigen, den Stress, der während der erzwungenen Immobilisierung auftritt. In Abwesenheit der Mikrobiota weisen Mäuse erheblich höhere Konzentrationen von Kortikosteron auf, einem Stresshormon im Hypothalamus, sowie reduzierte Spiegel des vom Gehirn abgeleiteten neurotrophen Faktors (BDNF; ein Protein, das die Neurogenese und das synaptische Wachstum stimuliert und die synaptische Plastizität und Übertragung moduliert). Interessanterweise kann dieses Phänomen teilweise durch die Neubesiedlung mit einer vielfältigen Mikrobiota im Erwachsenenalter umgekehrt werden, was darauf hindeutet, dass aktive Signale von der Mikrobiota eine entscheidende Rolle bei der Gehirnentwicklung spielen. Tatsächlich stellt die Besiedlung mit einer bestimmten Bakterienart, Bifidobacterium infantis, den Defekt wieder her (im Vergleich zur Monokolonisation mit Esherichia coli), was zeigt, dass nicht die allgemeine Wahrnehmung der Bakterien innerhalb der Population der einheimischen Mikroben, sondern Signale von bestimmten Bakterien das normale Verhalten steuern. Diese rigorose Demonstration, dass die Mikrobiota die Hypothalamus-Hypophysen-Nebennieren-Achse (HPA-Achse) beeinflusst, enthüllte eine bidirektionale Kommunikation zwischen dem Darm und dem Gehirn mit einem signifikanten Einfluss auf das Verhalten des Wirts.
Umgekehrt zeigen einige Stämme von GF-Mäusen (Swiss Webster, NIH Swiss, NMRI) in Abwesenheit von Restraint-Stress ein vermindertes Angstverhalten in Form einer erhöhten Exploration im Vergleich zu spezifisch pathogenfreien (SPF) Mäusen, die mit einer vielfältigen mikrobiellen Population besiedelt sind. So verbringen GF-Mäuse beispielsweise mehr Zeit im hellen Bereich einer Hell-Dunkel-Box sowie in den offenen Armen eines erhöhten Plus-Labyrinths als ihre kolonisierten Artgenossen, was ein Zeichen für ein vermindertes Angstverhalten ist, da Mäuse typischerweise den Wunsch haben, sich in einem geschlossenen, dunklen Bereich aufzuhalten. Wichtig ist, dass diese Verhaltensauswirkungen durch die Rekolonisierung der GF-Mäuse mit einer vollständigen SPF-Mikrobiota auf ein ähnliches Niveau wie bei konventionell aufgezogenen Mäusen gebracht werden können. Die Wirkung der Mikrobiota ist nicht unbedingt bei allen Mäusestämmen gleich. So zeigen beispielsweise SPF BALB/c- und C57Bl6-Mäuse im Vergleich zu anderen Stämmen, wie z. B. NIH Swiss-Mäusen, ein erhöhtes Angstverhalten. Das in BALB/c-Mäusen vorhandene Mikrobiom unterscheidet sich signifikant von dem in NIH Swiss-Mäusen vorhandenen. Wenn fäkale Mikrobiota von einem der beiden Stämme in GF-Mäuse des Gegenstücks transplantiert werden, wird das Verhalten des Elternstamms übertragen. Dieser interessante Befund impliziert, dass von der Mikrobiota abgeleitete Signale das Verhalten des Wirts steuern können. Darüber hinaus zeigen phänotypische Veränderungen nach fäkalen Mikrobiota-Transplantationen bei erwachsenen Mäusen, dass Angst aktiv durch die mikrobielle Population moduliert werden kann und nicht unbedingt entwicklungsbedingt ist. Es ist daher interessant zu überlegen, dass eine aktive Modulation der Population oder Funktion der Darmmikrobiota, wie z. B. durch probiotische Nahrungsergänzung, dazu beitragen kann, Stress- und Angstsymptome des Wirts zu verändern. Tatsächlich gibt es eine aktive und wachsende Reihe von Beobachtungen über die Wirkung probiotischer Arten auf das Verhalten des Wirts.
In einer solchen Studie zur probiotischen Nahrungsergänzung wurde beobachtet, dass Mäuse, die über einen Zeitraum von 28 Tagen mit dem probiotischen Bakterium Lactobacillus rhamnosus (JB-1) behandelt wurden, im erhöhten Plus-Labyrinth und im Open-Field-Test ein vermindertes Angstverhalten zeigten. Zusätzlich wird die Wirkung von L. rhamnosus auf das Angstverhalten bei Mäusen, die vagotomiert wurden und denen die Verbindung des Vagusnervs zwischen dem ENS und dem ZNS fehlt, abgeschwächt. Dies würde darauf hindeuten, dass mikrobielle Signale über den Vagusnerv geleitet werden können, um ZNS-Outputs (wie z. B. Verhalten) zu verändern, was die aktive Rolle der Mikrobiota bei der Vermittlung neurologischer Funktionen weiter impliziert. In ähnlicher Weise wurde bei der Behandlung mit B. longum 1714 und B. breve 1205 beobachtet, dass sie Angstverhalten im gleichen Ausmaß reduzieren wie das pharmazeutische Anti-Angst-Medikament Escitalopram. Andere Studien an Ratten, bei denen ein probiotischer Cocktail aus Lactobacillus helveticus R0052 und Bifidobacterium longum R0175 verwendet wurde, ergaben, dass die Behandlung mit diesen Mikroben über einen Zeitraum von 30 Tagen zu einer Verringerung der Angst in einem Elektroschockmodell führte, was weiter darauf hindeutet, dass die Funktionalität der Darmmikrobiota das Angstverhalten beeinflusst. Zusammengenommen bestätigen diese Studien die faszinierende Hypothese, dass eine aktive Modulation der Darmmikrobiota durch probiotische Nahrungsergänzungsmittel drastische Auswirkungen auf das Verhalten haben kann, möglicherweise mit therapeutischem Potenzial. Die gezielte Anregung der verdauung anregen kann somit ebenfalls eine positive Auswirkung haben.
Angst ist nicht das einzige Verhalten, das durch Signale von symbiotischen Bakterien moduliert wird. Dieselbe Studie, in der das Probiotikum L. rhamnosus (JB-1) zur Behandlung von Mäusen verwendet wurde, beobachtete auch, dass diese Mäuse ein vermindertes depressionsähnliches Verhalten zeigten, insbesondere im Forced-Swim-Test. Die probiotische Behandlung führte dazu, dass die Tiere weniger Zeit immobilisiert verbrachten, wenn sie in einen mit Wasser gefüllten Zylinder eingeführt wurden, anstatt zu versuchen, zu schwimmen. In ähnlicher Weise wurde in einer separaten Studie das Modell der mütterlichen Trennung von Depressionen bei Ratten verwendet, bei dem Welpen für eine bestimmte Zeit pro Tag bis zum Absetzen von ihren Müttern getrennt werden. Diese Studie stellte fest, dass das in diesem Modell induzierte depressionsähnliche Verhalten durch die Behandlung mit Bifidiobacterium infantis reduziert werden konnte. Bemerkenswerterweise führte die B. infantis-Behandlung zu einer ähnlichen Reduktion des depressionsähnlichen Verhaltens im Forced-Swim-Test wie die Behandlung mit dem pharmazeutischen Antidepressivum Citalopram, einem selektiven Serotonin-Wiederaufnahmehemmer (SSRI). Diese überraschenden Ergebnisse legen weiterhin nahe, dass die Zusammensetzung und/oder Funktion der Mikrobiota das Verhalten in erwachsenen Tieren aktiv moduliert.
Interessanterweise wurde beobachtet, dass die Einnahme von Probiotika oder sogar die Ernährung allein sowohl das Angst- als auch das Depressionsverhalten bei Mäusen sowie das Lernen und das Gedächtnis beeinflussen. Während einige Studien auch gezeigt haben, dass bestimmte Ernährungsweisen die Zusammensetzung des Mikrobioms verändern und Auswirkungen auf das Verhalten haben, ist es nicht klar, ob die mikrobielle Zusammensetzung selbst ursächlich für das beobachtete Depressionsverhalten und die Lernschwächen ist, die in diesen Studien beobachtet wurden. Funktionelle Studien, bei denen durch die Ernährung veränderte Mikrobiome transplantiert werden, wären unerlässlich, um eine mikrobielle Rolle zu etablieren. Nichtsdestotrotz dienen solche Beobachtungen dazu, den Weg zum Verständnis der Rolle zu ebnen, die die Zusammensetzung und Funktionalität einheimischer Mikroben bei der Gestaltung der Stimmung und des Verhaltens im Wirt spielen können.
Während die meisten Studien Tiermodelle verwendet haben, werden Arbeiten durchgeführt, um zu verstehen, ob die Mikrobiota ähnliche Rollen bei der Gestaltung der menschlichen neurologischen Funktion spielt. Eine kürzlich durchgeführte Humanstudie untersuchte, ob der Konsum eines fermentierten, probiotischen Milchprodukts (das Bifidobacterium animalis subsp Lactis, Streptococcus thermophilus, Lactobacillus bulgaricus und Lactococcus lactis subsp Lactis enthielt) einen Einfluss auf die Reaktion des Gehirns auf emotionale Reize haben könnte. Mithilfe der funktionellen Magnetresonanztomographie (fMRT) stellten Mayer und Kollegen fest, dass der probiotische Konsum über einen Zeitraum von vier Wochen die Verarbeitung von Emotionen beeinflussen konnte. Insbesondere waren diejenigen Regionen des Gehirns, die an der emotionalen Verarbeitung beteiligt sind, einschließlich der primären interozeptiven und somatosensorischen Regionen, nach emotionaler Stimulation (Aufgabe mit emotionalen Gesichtern) bei denjenigen Personen weniger aktiviert, die dieses probiotische Produkt konsumiert hatten. In ähnlicher Weise wurde in einer separaten Studie beobachtet, dass der Konsum von Probiotika selbstberichtete Gefühle von Traurigkeit und aggressive Gedanken reduzierte. Es ist wichtig zu erwähnen, dass diese besonderen Studien zwar klein waren und nicht genau untersuchten, wie der Bakteriencocktail Veränderungen der funktionellen Gehirnaktivität und der Stimmung vermittelte, sie dennoch stark darauf hindeuten, dass die Mikrobiota einige funktionelle Aspekte der Stimmung beim Menschen aktiv verändern kann. Eine größere Humanstudie mit fünfundfünfzig Personen untersuchte, ob der Konsum von Probiotika die Angst beeinflussen könnte (durch Fragebögen zur Selbsteinschätzung). Die Verabreichung von L. helveticus R0052 und B. longum R0175 führte zu einer Verringerung der selbstberichteten Angst und bemerkenswerterweise auch zu einer Verringerung des Cortisols im Urin. Zusammengenommen unterstützen diese Studien das Konzept, dass die Mikrobiota die neurologische Funktion beim Menschen beeinflusst und letztendlich die Stimmung und das Verhalten beeinflusst. Es sind jedoch zusätzliche Arbeiten mit größeren Kohortengrößen unter Verwendung eines Crossover-Studiendesigns und einer klinischen Bewertung erforderlich, um diese bahnbrechenden Beobachtungen für eine Darm-Mikrobiom-Gehirn-Verbindung beim Menschen zu validieren.
Interessanterweise wurde sowohl bei Menschen als auch bei Mäusen beobachtet, dass die probiotische Ergänzung mit fermentierten Milchprodukten nicht unbedingt die Zusammensetzung des Darmmikrobioms verändert. Stattdessen wird der transkriptionelle Zustand und die metabolische Aktivität der Mikrobiota verändert. Es ist daher interessant zu bedenken, dass diese Verhaltens- und neurologischen Veränderungen möglicherweise nicht unbedingt eine direkte Funktion der spezifischen Bakterienarten innerhalb der probiotischen Behandlung sind; vielmehr könnten die mikrobiell vermittelten Auswirkungen auf Emotionen auf einer breiteren Funktionalität der symbiotischen Bakterien im Darm beruhen. Die fortgesetzte Untersuchung, wie das Vorhandensein spezifischer Bakterienarten, insbesondere von Nischenarten mit geringer Häufigkeit, die Physiologie beeinflusst, aber die Gesamtpopulation der Darmmikroben nicht verändert, wird entscheidend sein, um die Funktion der Mikrobiota zu verstehen und wie sie effektiv genutzt und als potenzielle therapeutische Modalität für Verhaltensstörungen entwickelt werden kann.
Eine gut etablierte physiologische Funktion der Mikrobiota ist die Erzeugung essentieller Nährstoffe für die Physiologie des Wirts, wie z. B. Vitamine und andere Kofaktoren. Daher ist es verlockend zu spekulieren, dass diese Mikroben anschließend das Sättigungsgefühl verändern könnten und so beeinflussen, wie viel Nahrung der Wirt aufnimmt. Obwohl es keine eindeutigen Beweise dafür gibt, dass die Mikrobiota den Appetit und das Sättigungsgefühl direkt beeinflusst, gibt es interessante indirekte Beobachtungen. Nach der Einnahme von fermentierbaren, komplexen Kohlenhydraten verstoffwechselt die Mikrobiota Ballaststoffe zu kurzkettigen Fettsäuren (SCFAs) wie Acetat, Butyrat und Propionat. Interessanterweise werden im GI-Trakt produzierte SCFAs nicht nur ins Serum transportiert, sondern können auch die Blut-Hirn-Schranke (BHS) überwinden. Im Gehirn angekommen, hat ein bestimmtes SCFA, Acetat, physiologische Veränderungen im Hypothalamus bewirkt. Hier verändert Acetat den Spiegel der Neurotransmitter Glutamat, Glutamin und Gamma-Aminobuttersäure (GABA) sowie erhöht die Expression anorektischer Neuropeptide, die zusammen als Hormonsignale wirken, um den Appetit zu reduzieren. Insgesamt führt die Produktion von Acetat zur Unterdrückung des Appetits. Tatsächlich ergab eine kleine Studie an Menschen, dass die Fermentation komplexer Kohlenhydrate zu SCFAs durch die Mikrobiota direkt mit dem Gefühl der Sättigung korreliert war, was eine Grundlage für die Hypothese liefert, dass die symbiotischen Mikroben in der Lage sind, den Appetit des Wirts zu modulieren. In der Tat induzieren Veränderungen des Mikrobioms aufgrund einer spezifischen genetischen Mutation bei Mäusen ein metabolisches Syndrom, wahrscheinlich durch Veränderungen des Fressverhaltens und nicht durch Veränderungen des Stoffwechsels. Hierbei spielen probiotische lebensmittel eine wichtige Rolle.
Die Mikrobiota prägt das Sozialverhalten
Zahlreiche Facetten des Sozialverhaltens werden auch durch das Vorhandensein, die Zusammensetzung und die Funktionalität der Mikrobiota verändert. GF-Mäuse sind im Vergleich zu ihren SPF-kolonisierten Artgenossen deutlich sozial beeinträchtigt. GF-Mäuse suchen andere Mäuse (sowohl neue als auch vertraute) nicht so bereitwillig auf wie Mäuse, die ein vielfältiges mikrobielles Konsortium beherbergen, was darauf hindeutet, dass die Mikrobiota dieses Sozialverhalten beeinflusst. Überraschenderweise konnte die soziale Vermeidung durch die Rekolonisierung erwachsener Mäuse mit einer vollständigen Mikrobiota wiederhergestellt werden. Umgekehrt konnte der Defekt in der sozialen Kognition (d. h. die Fähigkeit, vertraute von unbekannten Mäusen zu unterscheiden) nach der Kolonisierung nicht wiederhergestellt werden. Daher haben Darmbakterien unterschiedliche Auswirkungen sowohl auf Entwicklungsaspekte als auch auf aktive Prozesse, die im Erwachsenenalter stattfinden und letztendlich langfristige Verhaltensmerkmale prägen.
Ein besonders interessantes Beispiel für mikrobiomgesteuertes Sozialverhalten ist die sexuelle Partnerwahl bei der Fruchtfliege Drosophila melanogaster. Fliegen, die mit Lactobacillus plantarum kolonisiert wurden, paaren sich bevorzugt nur mit ähnlich kolonisierten Fliegen und nicht mit Fliegen, die von anderen Bakterienarten kolonisiert wurden. Dies ist auf die erhöhte Produktion bestimmter Pheromone zurückzuführen, deren Vorläufer von L. plantarum in diesen Fliegen produziert werden. Dies ist ein starkes, mechanistisches Beispiel, um zu verstehen, wie das Mikrobiom das äußerst komplexe Sozialverhalten der Partnerwahl beeinflussen kann. Aufbauend darauf fand eine interessante Studie über das Sozialverhalten von Hyänen heraus, dass einzelne soziale Gruppen dieser Tiere in ihren Duftdrüsen unterschiedliche Mikrobiota beherbergten. Es ist bekannt, dass in Duftdrüsen lebende symbiotische Bakterien flüchtige Verbindungen produzieren, und jede einzigartige mikrobielle Gemeinschaft produziert unterschiedliche Verhältnisse dieser Verbindungen. Da verschiedene soziale Gruppen ähnliche Mikrobiome aufwiesen, werden Individuen wahrscheinlich direkt aufgrund der Zusammensetzung der Mikroben in ihren Drüsen als zu einer bestimmten sozialen Gruppe gehörig erkannt. Diese Studien stützen die Vorstellung, dass symbiotische Bakterien beeinflussen, wie ein Wirt in sozialen Umgebungen interagiert, und modulieren, wie der Wirt neue versus vertraute Individuen sowohl für die Partnerwahl als auch für die soziale Gruppierung wahrnimmt. Die Auswirkungen dieses mikrobiellen Einflusses auf das Sozialverhalten sind den Evolutionsbiologen nicht entgangen. Wenn Darmbakterien die neurologische Funktion modulieren und zur Wahl des Partners führen, kann das Mikrobiom daher eine bedeutende Rolle bei der Steuerung der Evolution seiner Wirte spielen. Indem die Mikrobiota beeinflusst, wie Individuen interagieren und eine vertikale genetische Übertragung erfahren, könnte sie letztendlich ein entscheidender Faktor in der Evolution der Metazoenarten sein.
Der Zusammenhang zwischen Darmbakterien und Störungen mit sozialer Beeinträchtigung
Die Autismus-Spektrum-Störung (ASD) umfasst eine Reihe komplexer neurologischer Entwicklungsstörungen, die durch repetitive/stereotypische Verhaltensweisen und Defizite in der Kommunikation und sozialen Interaktion gekennzeichnet sind. Interessanterweise weist eine beträchtliche Untergruppe von ASD-Kindern GI-Komplikationen auf, darunter Verstopfung, erhöhte Darmpermeabilität und eine veränderte Zusammensetzung des Darmmikrobioms. Mäuse, die autismusähnliche Verhaltensweisen zeigen, haben ein deutlich verändertes Mikrobiom im Vergleich zu neurotypischen Kontrollen und weisen eine Zunahme der Permeabilität des Dickdarms auf und zeigen korrelativ Unterschiede in den Serummetaboliten. Überraschenderweise konnte die Behandlung mit einem einzigen Organismus, Bacteroides fragilis, die Darmpermeabilitätsdefekte in einem Mausmodell von ASD wiederherstellen. Während die Behandlung mit diesem Probiotikum die Gesamtzusammensetzung der mikrobiellen Population nicht wiederherstellte, konnte die Behandlung mit B. fragilis die Spiegel einer kleinen Anzahl spezifischer Arten wiederherstellen. Bemerkenswerterweise rettete die B. fragilis-Behandlung einige Verhaltensdefekte, darunter stereotypes Verhalten (zwanghaftes Vergraben von Murmeln), Kommunikationsdefizite (ultraschalle Vokalisationen) und Angstverhalten (Open-Field-Exploration).
Es hat sich gezeigt, dass B. fragilis die Entwicklung und Funktion des Immunsystems fördert; Die Behandlung mit B. fragilis stellte jedoch nicht mehrere Aspekte der Immunfehlfunktion in einem Tiermodell von Autismus wieder her. Stattdessen wurden die Spiegel von Serummetaboliten, die bei Mäusen mit ASD-bedingtem Verhalten verändert gefunden wurden, auf normale Werte wiederhergestellt. Die Verabreichung eines spezifischen Serummetaboliten, der bei Mäusen mit Verhaltensdefiziten erhöht war, nämlich 4-Ethylphenylsulfat (4EPS), an gesunde Tiere reichte aus, um ein angstähnliches Verhalten zu induzieren. Da 4EPS vermutlich mikrobiellen Ursprungs ist, zeigt dies bemerkenswerterweise, dass definierte Moleküle aus dem Mikrobiom das Verhalten bei Säugetieren beeinflussen können. In ähnlicher Weise zeigte eine andere Studie, dass Mäuse mit ASD-Merkmalen ein signifikant verändertes Mikrobiom und eine erhöhte Darmentzündung aufweisen. Obwohl noch korrelativ, legen diese Daten zusammen nahe, dass bestimmte neurologische Entwicklungsstörungen wie Autismus mikrobielle Ursachen haben könnten, eine Hypothese, die weitere Validierung sowohl in Tiermodellen als auch in Humanstudien erfordert. Die Vorstellung, dass das Darmmikrobiom einen umweltbedingten Risikofaktor für Autismus darstellt, wird durch epidemiologische Studien gestützt, die einen raschen Anstieg der ASD-Diagnosen in den letzten Jahrzehnten zeigen, was darauf hindeutet, dass die Genetik allein viele Krankheitsfälle nicht erklären kann. Wenn dies zutrifft, könnte die gezielte Reparatur eines veränderten Mikrobioms durch Interventionen wie Probiotika, Präbiotika oder Ernährung natürliche, sichere und wirksame Behandlungen für neurologische Erkrankungen wie Autismus darstellen.
Mikrobiomvermittelte Veränderungen der Neurophysiologie
Die Beobachtung, dass GF- oder probiotisch behandelte Mäuse ein verändertes Verhalten aufweisen, wirft zahlreiche interessante Fragen im Zusammenhang mit der Darm-Hirn-Kommunikation auf. Wirken mikrobiell abgeleitete Signale direkt auf das Nervensystem über das Immun- oder Stoffwechselsystem oder andere Wege? Beruht der Einfluss des Mikrobioms auf Entwicklungseffekten, oder ist die Mikrobiom-Hirn-Achse ein aktiv modulierter Prozess? Welche neurophysiologischen Veränderungen treten im Gehirn aufgrund von Veränderungen des Mikrobioms auf, die Verhaltensauswirkungen zugrunde liegen können? Mechanismen und Folgen für die Fernkommunikation zwischen Darmbakterien und dem Gehirn sind wahrscheinlich kontextspezifisch und schließen sich nicht gegenseitig aus.
In einigen Fällen gibt es Hinweise darauf, dass mikrobiotisch vermittelte Ergebnisse in einem bestimmten Zeitraum der Entwicklung auftreten müssen und anschließend irreversible neurologische Auswirkungen haben. In anderen Beispielen kann die neurologische Funktion aktiv durch Signale aus dem Mikrobiom moduliert werden. Zum Beispiel stellt die Rekolonisierung adulter GF-Mäuse mit einer vollständigen Mikrobiota ihr Angstverhalten auf das von SPF-Mäusen wieder her, was zeigt, dass die Kontrolle des Angstverhaltens durch einen aktiven und konstanten Prozess zwischen Signalen aus dem Mikrobiom und dem ZNS erfolgen kann. GF-Mäuse weisen jedoch auch niedrigere Spiegel von BDNF, Serotonin (5-HT; 5-Hydroxytryptamin) und spezifischen 5-HT-Rezeptoren (z. B. 5HT1A) in Regionen wie der Amygdala und dem Hippocampus auf. Die Spiegel dieser Wirtsmoleküle werden bei der Rekolonisierung adulter Mäuse nicht wiederhergestellt, was darauf hindeutet, dass bestimmte Phänotypen wahrscheinlich von der Mikrobiota während der fötalen Entwicklung oder in der Adoleszenz programmiert werden.
Andere Prozesse werden aktiver vom Mikrobiom moduliert. Es wurde auch beobachtet, dass GF-Mäuse eine erhöhte Umsatzrate von Noradrenalin, Dopamin und 5-HT in der Striatumregion des Gehirns aufweisen. Eine hohe Umsatzrate kann anschließend einen Einfluss auf die Steady-State-Spiegel dieser Neurotransmitter haben. Der Umsatz von Norepinephrin und Dopamin könnte insbesondere für die Zunahme der motorischen Aktivität verantwortlich sein, die bei GF-Mäusen gut dokumentiert ist, da diese Neurotransmitter eine Rolle bei der Erhöhung der Durchblutung der Muskeln bzw. der zentralen Motorsteuerung spielen.
Während Veränderungen der Population oder Funktion des Mikrobioms zu einer unterschiedlichen Produktion von Metaboliten führen können, die in die Peripherie gelangen, ist unbekannt, ob diese Moleküle die BHS passieren und die neurologische Funktion beeinflussen können. Interessanterweise haben GF-Mäuse eine signifikant erhöhte Permeabilität der BHS sowohl während der fötalen Entwicklung als auch im Erwachsenenalter. Diese Erhöhung der Permeabilität ist auf eine verminderte Expression von Endothel-Tight-Junction-Proteinen, insbesondere Occludin und Claudin-5, in Abwesenheit der Mikrobiota zurückzuführen. Interessanterweise konnte die Monokolonisation mit entweder Clostridium tyrobutyricum oder Bacteroides thetaiotaomicron die BHS-Integrität (und die Expression von Tight Junctions) wiederherstellen, selbst bei adulten Mäusen. Da diese Arten SCFAs aus der Fermentation komplexer Kohlenhydrate im Darm produzieren, wurde anschließend beobachtet, dass das SCFA-Butyrat ausreichte, um die BHS-Integrität wiederherzustellen. Dies deutet darauf hin, dass metabolische Signale, die von der Darmmikrobiota abgeleitet sind, den physiologischen Status der BHS, einem Ort, der weit von ihrem Ursprung entfernt ist, aktiv und konstant beeinflussen. Es ist jedoch unbekannt, ob andere SCFAs oder mikrobiell abgeleitete Signale oder sogar mikrobielle Arten ebenfalls eine Rolle bei der Beeinflussung der BHS-Permeabilität spielen können. Dieser Befund hat wichtige Implikationen für andere physiologische Prozesse: Er deutet darauf hin, dass Serummetaboliten, die normalerweise nicht in das Gehirnparenchym gelangen, potenziell die BHS aufgrund des Status der Mikrobiota passieren können, was einen Mechanismus für Darmmikroben bietet, um die Konzentrationen zahlreicher Metaboliten zu kontrollieren, die direkt auf neurologische Systeme wirken können.
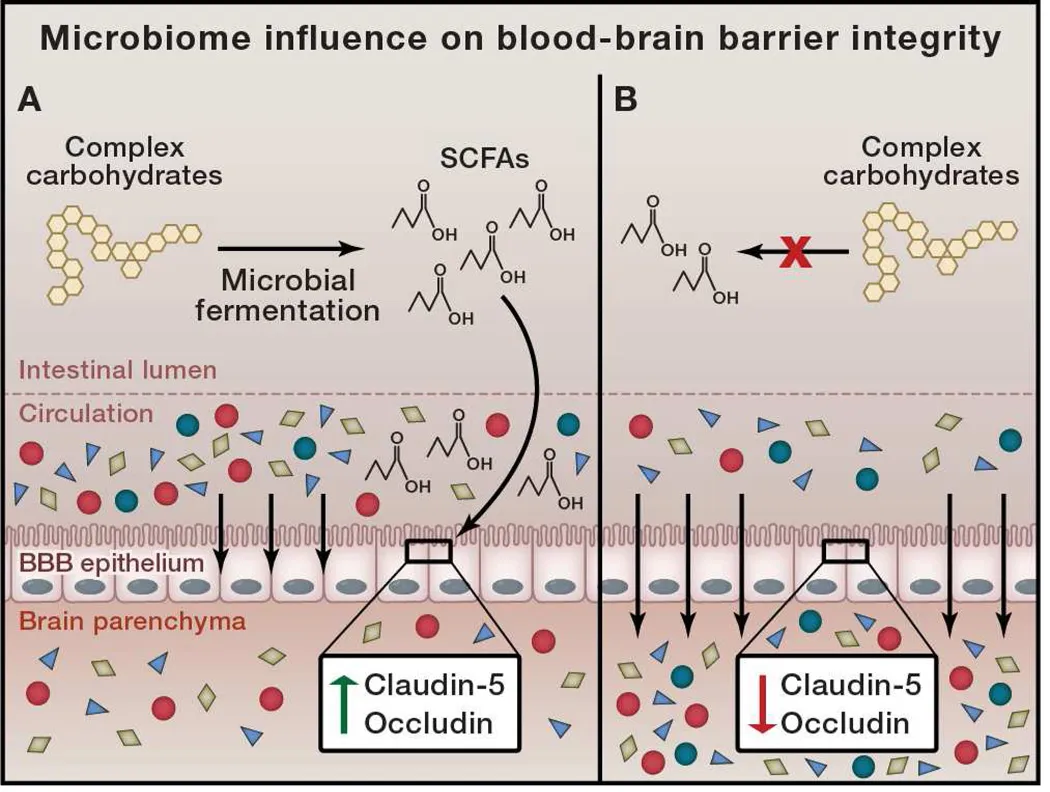 Mikrobiom-Einfluss auf die Integrität der Blut-Hirn-Schranke
Mikrobiom-Einfluss auf die Integrität der Blut-Hirn-Schranke
Darmmikroben sind in der Lage, komplexe Kohlenhydrate zu kurzkettigen Fettsäuren (SCFAs) zu fermentieren. A) Mikrobiell produzierte SCFAs signalisieren Epithelzellen, die die Blut-Hirn-Schranke (BHS) bilden, und erhöhen die Produktion der Tight-Junction-Proteine Claudin-5 und Occludin. Dies führt zu einer dichten und selektiven Barriere, die verhindert, dass unerwünschte Metaboliten in das Gehirnparenchym gelangen. B) In Abwesenheit mikrobieller Fermentation findet keine SCFA-Signalübertragung statt, und Tight-Junction-Proteine werden unterdrückt. Dies führt zu einer erhöhten Permeabilität der BHS und einem Verlust der selektiven Barriere für Serummetaboliten.
Regulierung der Neurotransmitterspiegel durch die Darmmikrobiota
Während beobachtet wurde, dass Veränderungen der Neurophysiologie durch das Mikrobiom vermittelt werden können, ist der genaue Mechanismus, durch den dieser Einfluss auftritt, noch unklar. Obwohl die Veränderung der Permeabilität der BHS den Fluss von Serummetaboliten in das Gehirn hinein und aus dem Gehirn heraus verändern würde, gibt es potenziell direktere Wege, wie das Mikrobiom die neurologische Funktion verändern kann. Einer der direktesten Mechanismen könnte darin bestehen, die Konzentration verschiedener Neurotransmitter sowohl im Gehirn als auch in der Peripherie zu kontrollieren. Zum Beispiel sind die 5-HT-Spiegel im peripheren Serum in Abwesenheit der Darmmikrobiota reduziert. Diese Abnahme entspricht niedrigeren Spiegeln von 5-HT-Metaboliten und -Vorläufern im intestinalen Luminalinhalt und im Urin. Der überwiegende Teil des 5-HT im Körper (~90 %) wird von enterochromaffinen Zellen im Darm produziert. Die Freisetzung von 5-HT durch enterochromaffine Zellen ist notwendig, um die Dickdarmmotilität zu modulieren. Kürzlich wurde gezeigt, dass mikrobiell abgeleitete SCFAs in der Lage sind, die 5-HT-Produktion durch enterochromaffine Zellen in vitro und in Tieren zu induzieren. Darüber hinaus ist nicht bekannt, dass 5-HT die Blut-Hirn-Schranke überwindet, und daher kann die Mikrobiomkontrolle des 5-HT-Umsatzes im Gehirn stattdessen durch Veränderungen der 5-HT-Vorläuferspiegel erfolgen.
Insbesondere die essentielle Aminosäure Tryptophan ist ein zentraler Vorläufer der 5-HT-Synthese. Tryptophan selbst wird von der Darmmikrobiota erzeugt, und in der Peripherie vorhandenes Tryptophan kann die BHS überwinden, wo es dann an der 5-HT-Synthese teilnehmen kann. Dennoch hätte selbst die lokale Stimulation und Produktion von 5-HT im GI-Trakt wichtige Auswirkungen auf die Physiologie des Wirts, da 5-HT die gastrointestinale Motilität moduliert. Interessanterweise können die 5-HT-Spiegel im Darm bei GF-Mäusen nach der Kolonisierung mit einem definierten Cocktail sporenbildender Darmbakterien wiederhergestellt werden, ein Prozess, der die Thrombozytenaggregation und die Blutgerinnung reguliert. Nicht-SCFA-Metaboliten, die von dieser mikrobiellen
