Die vorliegende Studie berichtet über die Aktivität von BILD 1633 SE gegen Acyclovir (ACV)-resistente Herpes-simplex-Virus (HSV)-Infektionen in athymischen Nacktmäusen (nu/nu). BILD 1633 SE ist ein neuartiger peptidomimetischer Inhibitor der HSV-Ribonukleotidreduktase (RR). In vitro ist es wirksamer als ACV gegen verschiedene Stämme von Wildtyp- sowie ACV-resistenten HSV-Mutanten. Seine In-vivo-Aktivität wurde gegen kutane Virusinfektionen in athymischen Nacktmäusen getestet, die mit den ACV-resistenten Isolaten HSV Typ 1 (HSV-1) dlsptk und PAAr5 infiziert waren, die Mutationen im viralen Thymidinkinase-Gen bzw. im Polymerase-Gen enthalten.
Nach kutaner Infektion athymischer Nacktmäuse induzierten sowohl HSV-1 dlsptk als auch PAAr5 signifikante, reproduzierbare und persistierende kutane Läsionen, die länger als 2 Wochen andauerten. Eine 10-tägige Behandlung mit ACV, die viermal täglich topisch als 5%ige Creme oder oral mit bis zu 5 mg/ml im Trinkwasser verabreicht wurde, war teilweise wirksam gegen HSV-1 PAAr5-Infektion mit einer Reduktion der Fläche unter der Konzentrations-Zeit-Kurve (AUC) von 34 bis 48%. Die Wirkungen von ACV gegen HSV-1 dlsptk-Infektion waren nicht signifikant, wenn es topisch verabreicht wurde, und nur marginal, wenn es im Trinkwasser gegeben wurde. Eine Behandlung unter identischen Bedingungen mit 5%igem topischem BILD 1633 SE reduzierte signifikant die kutanen Läsionen, die durch sowohl HSV-1 dlsptk- als auch PAAr5-Infektionen verursacht wurden. Die Wirkung von BILD 1633 SE gegen HSV-1 PAAr5-Infektionen war stärker ausgeprägt und dosisabhängig, mit AUC-Reduktionen von 96 und 67% gegen Infektionen mit 106 bzw. 107 PFU pro Inokulationsstelle. BILD 1633 SE verringerte auch signifikant die Läsionen, die durch HSV-1 dlsptk-Infektion verursacht wurden (28 bis 51% AUC-Reduktion). Eine Kombinationstherapie mit topischem BILD 1633 SE (5%) und ACV im Trinkwasser (5 mg/ml) erzeugte eine antivirale Wirkung gegen HSV-1 dlsptk- und PAAr5-Infektionen, die größer war als die Summe der Wirkungen beider Medikamente. Dies ist der erste Bericht, dass ein selektiver HSV-RR-Subunit-Assoziationsinhibitor gegen ACV-resistente HSV-Infektionen in vivo wirksam sein kann.
Herpes-simplex-Viren (HSV) kodieren eine Ribonukleotidreduktase (RR), die die Synthese der Desoxyribonukleotid-Vorläufer katalysiert, die für die DNA-Synthese benötigt werden. Dieses Enzym weist viele Ähnlichkeiten mit der zellulären RR des Wirts auf, unterscheidet sich aber deutlich von dieser hinsichtlich der primären Aminosäuresequenzen und der allosterischen Regulation. Beide RRs bestehen aus zwei Untereinheiten. Die größere Untereinheit enthält redoxaktive Thiole, die den Wasserstoff für die Nukleotidreduktion liefern. Die kleinere Untereinheit enthält ein zweikerniges μ-Oxo-verbrücktes Eisenzentrum, das mit einem Tyrosyl-freien Radikal assoziiert ist. Das Carboxyterminus der RR-kleinen Untereinheit ist entscheidend für die Subunit-Assoziation und für die katalytische Aktivität des Enzyms. Obwohl HSV-RR für die Virusreplikation in exponentiell wachsenden Zellen nicht erforderlich ist, ist es in nicht teilenden Zellen notwendig und für die vollständige Ausprägung der Pathogenität von HSV in Tiermodellen der Primärinfektion und für die Reaktivierung aus der Latenz erforderlich. Daher stellt HSV-RR ein interessantes Ziel für die Anti-Herpesvirus-Therapie dar. Es wurde berichtet, dass nicht-selektive RR-Inhibitoren, wie z. B. 2′-Fluormethylen-2′-desoxycytidin und A1110U, die Aktivität von Acyclovir (ACV) sowohl in vitro als auch in vivo gegen Wildtyp- und ACV-resistente HSV-Infektionen verstärken. Diese RR-Inhibitoren haben sich jedoch nicht als Monotherapie als nützlich erwiesen, und daher wurde die Kombinationstherapie nicht eindeutig validiert, was zum Teil auf die mangelnde Spezifität und die Toxizität dieser Mittel zurückzuführen ist. Unsere Gruppe hat eine Klasse von selektiven HSV-RR-Subunit-Assoziationsinhibitoren entwickelt, die als Mimesen des Carboxyterminus der kleinen Untereinheit wirken. Wir haben kürzlich über die In-vivo-Aktivität einer der frühesten Leitsubstanzen, BILD 1263, als Monotherapie gegen HSV-Typ-1 (HSV-1)-induzierte Augenerkrankung bei Mäusen berichtet. In der vorliegenden Studie untersuchten wir die Auswirkungen von BILD 1633 SE, einem wirksameren HSV-RR-Inhibitor, gegen kutane ACV-resistente HSV-1-Infektionen im athymischen Nacktmausmodell, wenn BILD 1633 SE entweder allein oder in Kombination mit ACV verwendet wurde. Die athymische Nacktmaus wurde gewählt, weil ACV-resistentes HSV-1 bei normalen Mäusen keine signifikante Erkrankung auslöst. Ein Mangel an funktionellen T-Zellen macht athymische Nacktmäuse anfälliger für kutane Infektionen durch ACV-resistentes HSV-1 und besser geeignet für die Arzneimittelbewertung. Da ACV-resistente HSV-Infektionen hauptsächlich bei immungeschwächten Patienten erhebliche Erkrankungen verursachen, können die aus diesen immundefizienten Tieren gewonnenen Informationen klinisch relevant sein. Unsere Ergebnisse deuten darauf hin, dass BILD 1633 SE bei der Behandlung von ACV-resistenten HSV-Infektionen in diesem Modell wirksam ist, wenn es entweder allein oder in Kombination mit ACV verwendet wird. Daher kann die selektive Hemmung von HSV-RR durch peptidomimetische Subunit-Assoziationsinhibitoren eine potenzielle alternative topische Therapie für die Behandlung von ACV-resistenten HSV-Infektionen beim Menschen darstellen.
 Molekulare Struktur von BILD 1633 SE. Me, Methyl.
Molekulare Struktur von BILD 1633 SE. Me, Methyl.
MATERIALIEN UND METHODEN
Viren.
In der vorliegenden Studie wurden vier verschiedene Laborstämme von HSV-1 verwendet. Dazu gehören zwei Wildtypstämme, HSV-1 F und KOS, sowie zwei ACV-resistente Stämme, dlsptk und PAAr5. Beide Wildtyp-HSV-1-Stämme wurden bereits an anderer Stelle beschrieben. Der ACV-resistente, Thymidinkinase (TK)-defiziente HSV-1-Stamm dlsptk und die DNA-Polymerase-Mutante PAAr5 wurden freundlicherweise von D. Coen zur Verfügung gestellt. Virusstämme wurden routinemäßig in Vero-Zellen (Afrikanische Grüne Affenniere) gezüchtet, und Virustiter wurden durch einen Standard-Plaque-Assay mit konfluenten Vero-Zellen bestimmt.
Verbindungen.
Die Herstellung von BILD 1633 SE basierte auf unserem zuvor veröffentlichten Verfahren. Die [α-(R)-Methyl-3-cyclohexyl]-propionyl-Funktionalität des N-terminalen Teils von BILD 1633 SE wird im letzten Schritt der Synthese durch Kondensation des entsprechenden Säurechlorids eingeführt.
In-vitro-Antivirus-Assay.
Antivirale Assays wurden im Wesentlichen wie zuvor beschrieben durchgeführt. Baby-Hamster-Niere (BHK)-21/C13 (ATCC CCL 10)-Zellen wurden in 96-Well-Kulturplatten mit einer Dichte von 5.000 Zellen pro Well in α-minimalem essentiellem Medium, das 8% (Vol/Vol) fötales Rinderserum (Gibco) enthielt, ausgesät, und die Platten wurden bei 37°C mit 5% CO2 inkubiert. Nach 6 h wurde die Konzentration von fötalem Rinderserum auf 0,5% (Vol/Vol) reduziert und die Zellen wurden 3 Tage lang serumgehungert. Serumgehungerte Zellmonolayer wurden mit HSV-1 F, KOS, PAAr5 und dlsptk mit einer Multiplizität der Infektion von 0,05 in definiertem Medium infiziert. Das definierte Medium bestand aus F-12-Medium, Dulbeccos modifiziertem Eagle-Medium und BGjb-Medium (6:3:1; Vol/Vol) mit 2 g Rinderserumalbumin pro Liter, 2,38 g HEPES pro Liter, 50 mg Garamycin pro Liter, 100 μg Cortisol pro Liter, 1 μg Insulin pro Liter, 0,4 μg Trijodthyromin pro Liter, 0,2 μg Parathormon pro Liter, 10 μg Glucagon pro Liter, 0,1 μg Epidermalwachstumsfaktor pro Liter, 0,2 μg Fibroblastenwachstumsfaktor pro Liter und 10 mg Transferrin pro Liter. Nach 1 h wurden die HSV-infizierten Zellen mit definiertem Medium gespült und dann mit Testverbindungen für 24 h für die Stämme F und KOS und 44 h für die Stämme PAAr5 und dlsptk inkubiert. Das Ausmaß der Replikation wurde durch einen neuartigen Enzyme-Linked Immunosorbent Assay (ELISA) beurteilt. Die Zellen wurden mit 0,063% Glutaraldehyd in phosphatgepufferter Kochsalzlösung (PBS) für 30 min fixiert und mit 0,5% Casein in PBS für 1 h blockiert. Danach wurde der Maus-Monoklonale Antikörper C11, der das späte Glykoprotein C von HSV-1 erkennt, für 2 h in jedes Well gegeben. Nachdem die Zellen dreimal mit PBS, das 0,05% Tween 20 enthielt, gewaschen wurden, wurde der gebundene monoklonale Antikörper mit Schaf-Anti-Maus-Immunglobulin G Meerrettichperoxidase für 1 h im Dunkeln detektiert. Die Platten wurden dreimal mit PBS und einmal mit 0,1 M Natriumcitrat (pH 4,5) gewaschen. ortho-Phenylendiamindihydrochlorid (Gibco) wurde als Substrat für 30 min im Dunkeln verwendet, und die Farbentwicklung in einzelnen Wells wurde bei 450 nm mit einem Titertek-Mikroplatten-Spektralphotometer überwacht. Für Hemmungsstudien wurden Verbindungen in dreifachen seriellen Verdünnungen getestet. Stammlösungen von Verbindungen wurden durch Lösen jeder Verbindung in Dimethylsulfoxid (DMSO) und Verdünnen der Lösung mit definiertem Medium auf eine endgültige DMSO-Konzentration von 1% hergestellt. Stammlösungen wurden routinemäßig für 20 min in eiskaltem Wasser beschallt und durch 0,22-μm-Porengröße-Millex-Filter (Millipore) filtriert. Die 50% effektiven Konzentrationen (EC50s) wurden aus Diagrammen der Hemmung der Virusreplikation als Funktion der Verbindungskonzentration bestimmt. Die Zytotoxizität von BILD 1633 SE für serumgehungerte Zellen wurde durch einen 3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazoliumbromid (MTT)-Assay bestimmt.
In-vitro-Studien zur Medikamentenkombination.
Die antivirale Aktivität von BILD 1633 SE in Kombination mit ACV gegen Wildtyp- und ACV-resistentes HSV-1 wurde durch den oben beschriebenen 96-Well-ELISA beurteilt. Die Bewertung von Medikamenteninteraktionen wurde durch die Isobolenmethode durchgeführt. Bei dieser Methode wurden ausgewählte Konzentrationen von BILD 1633 SE in Kombination mit verschiedenen Dosen von ACV getestet, und es wurden durchschnittliche EC50s von ACV aus doppelten Dosis-Wirkungs-Kurven bestimmt. Diese Werte wurden verwendet, um FEC50 (ACV) zu berechnen, das das Verhältnis der Konzentration von ACV darstellt, die erforderlich ist, um die HSV-1-Replikation um 50% in Gegenwart einer festen Konzentration von BILD 1633 SE zu hemmen, zur Konzentration von ACV, die erforderlich ist, um die HSV-1-Replikation um 50% in Abwesenheit von BILD 1633 SE zu hemmen. Die Isobologramm-Darstellung wird erhalten, indem FEC50 (ACV) als Funktion des Verhältnisses der festen Konzentration von BILD 1633 SE zur EC50 von BILD 1633 SE in Abwesenheit von ACV aufgetragen wird. In dieser Darstellung, wenn experimentelle Datenpunkte für die in Kombination verwendeten Medikamente auf der Hypotenuse liegen, sind die Wirkungen der beiden Medikamente additiv. Wenn experimentelle Datenpunkte unter die theoretische Linie für nicht interagierende Medikamente fallen, werden die Wirkungen der beiden Medikamente als synergistisch betrachtet.
Tiere.
Athymische Nacktmäuse (weibliche nu/nu-CD1-Mäuse von Charles River Canada, St. Constant, Quebec, Kanada) im Alter von 5 bis 6 Wochen wurden für alle Experimente verwendet. Die Tiere wurden in Mikroisolator-Käfigen innerhalb von halbstarren Isolatoren mit sterilem Futter, Wasser und Einstreu untergebracht. Alle Manipulationen wurden innerhalb von Sicherheitswerkbänken des Typs II (Nuaire, Plymouth, Minn.) gemäß den vom Canadian Council on Animal Care (Ottawa, Ontario, Kanada) genehmigten Protokollen durchgeführt.
Kutane Inokulation.
Die Tiere wurden unter Halothan-Anästhesie mit ACV-resistenten HSV-1 dlsptk- oder PAAr5-Mutanten inokuliert, indem 10 μl des gewünschten Virusstamms auf einer Fläche von etwa 1 cm2 auf jeder Seite der dorsalen Haut für 10 s aufgeraut und gerieben wurden.
Behandlungen und Medikamentenbewertung.
Sowohl ACV als auch BILD 1633 SE wurden topisch in einem Creme-Vehikel verabreicht, das 16% DMSO, 5% Linolsäure, 16% Cremophor EL und 63% Polyvinylalkohol (25%ige Lösung in 100 mM HEPES-Puffer [pH 8,5]) enthielt. Alle topischen Behandlungen wurden 3 h nach der Inokulation begonnen und für 10 Tage fortgesetzt (viermal täglich zwischen 8:30 Uhr und 17:30 Uhr). In einigen Experimenten wurde ACV unmittelbar nach der Inokulation oral im Trinkwasser verabreicht. Topische Läsionen und systemische Erkrankungen wurden täglich beobachtet. Die folgenden Kriterien wurden angewendet, um topische Läsionen zu bewerten: 0, keine Läsionen; 1, diskrete Vesikel; 2, zwei oder mehr offene Läsionen; 3, separate Ulzerationen; und 4, Zosterbandformationen. Der Beginn und der zeitliche Verlauf topischer Läsionen sind abhängig vom Titer des Inokulums. Unter den aktuellen experimentellen Bedingungen wurden topische Läsionen innerhalb von 2 bis 3 Tagen sichtbar und erreichten ihren Höhepunkt innerhalb von etwa 10 bis 13 Tagen; dies war abhängig vom Titer des Inokulums. Obwohl bei mit PAAr5-Mutanten infizierten Tieren ein gewisses Maß an spontaner Regression auftrat, persistierten topische Läsionen über die gesamte Dauer des Experiments. Nur wenige (weniger als 10%) der mit PAAr5 infizierten Mäuse entwickelten nach dem Auftreten schwerer topischer Läsionen eine systemische Erkrankung (disseminierte Infektionen, neurologische und körperliche Anomalien und Mortalität). Daher wurde die systemische Erkrankung nicht für die Medikamentenbewertung verwendet. Topische Läsionsdaten werden in Form des Mittelwerts und des Standardfehlers des Mittelwerts (SEM) dargestellt. Tägliche Läsionswerte und die Flächen unter der Kurve (AUC) der Läsionswerte werden auf statistische Signifikanz durch die Varianzanalyse gefolgt von Student-Newman-Keuls-Mehrfachvergleichen mit SAS-Software verglichen (SAS Institute, Cary, N.C.). Ein P-Wert von <0,05 wurde als statistisch signifikant angesehen. Informationen zu sportlichen Aktivitäten finden Sie unter zdf sportstudio.
ERGEBNISSE
Vergleichende In-vitro-Aktivitäten von BILD 1633 SE und ACV gegen verschiedene HSV-1-Stämme.
Abbildung 1 zeigt die Struktur des HSV-RR-Subunit-Assoziationsinhibitors BILD 1633 SE. Diese Verbindung hemmt HSV-RR mit einer 50%igen Hemmkonzentration von 3 nM, wie durch einen kompetitiven Bindungsassay bestimmt wurde. Wie bereits veröffentlichte Inhibitoren dieser Klasse beeinflusst es die Aktivität der menschlichen RR bei einer Konzentration von bis zu 250 μM nicht, basierend auf dem Enzymassay. Daher stellt diese Verbindung einen hochselektiven HSV-RR-Inhibitor dar. Wie in Tabelle 1 angegeben, ist BILD 1633 SE etwa 10-mal wirksamer als ACV bei der Hemmung der Replikation der Wildtypstämme HSV-1 F und KOS (EC50 = 0,4 μM) und etwa 100-mal wirksamer als ACV gegen beide ACV-resistenten Stämme. Darüber hinaus ist diese Verbindung etwa dreimal aktiver gegen die ACV-resistente Mutante PAAr5 als gegen beide Wildtypstämme und die dlsptk-HSV-1-Stämme. Die 50-prozentige zytotoxische Konzentration von BILD 1633 SE beträgt 14 μM, gemessen durch den In-vitro-MTT-Assay, was einen Selektivitätsindex von 35 ergibt. Verglichen mit der zuvor veröffentlichten Potenz von BILD 1263 ist BILD 1633 SE in vitro etwa 5- bis 10-mal wirksamer gegen alle untersuchten Viren (Tabelle 1) und in vivo gegen HSV-1-Infektionen im Maus-Augenmodell (unveröffentlichte Daten).
Verwandte Themen sind künstlerische gymnastik und leichtathletik turnen.
TABELLE 1.
Vergleichende In-vitro-antivirale Aktivitäten von BILD 1633 SE und ACV gegen verschiedene HSV-1-Stämme
| HSV-1-Stamm | EC50 (μM) |
|---|---|
| BILD 1633 SE | |
| F | 0,35 ± 0,10 |
| KOS | 0,43 ± 0,06 |
| dlsptk | 0,46 ± 0,09 |
| PAAr5 | 0,14 ± 0,02 |
aDie Werte stellen die Mittelwerte ± Standardabweichungen aus mindestens 10 Bestimmungen dar.
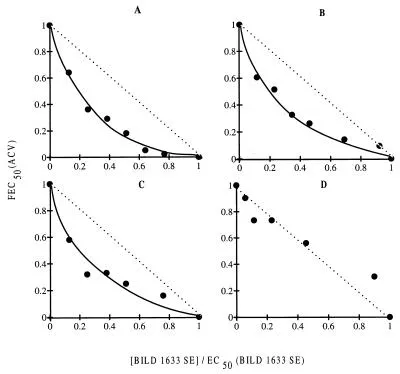
Als BILD 1633 SE in vitro in Kombination mit ACV getestet wurde, wurde die antivirale Aktivität von ACV gegen HSV-1 F, KOS und dlsptk verstärkt, ohne dass es zu einer Toxizität für die konfluenten BHK-Zellen kam. Der synergistische Effekt von BILD 1633 SE ist deutlich in Abbildung 2A, B und C zu erkennen, die die Isobologramm-Darstellung aus einem ELISA-basierten antiviralen Assay zeigt. Bei einer Konzentration von BILD 1633 SE, die eine 30%ige Hemmung der Virusreplikation hervorrief, sank die EC50 von ACV für jedes Virus um etwa das 10- bis 20-fache. Gegen den ACV-resistenten Virusstamm PAAr5 wurde keine Synergie von ACV mit BILD 1633 SE beobachtet. Wie die Isobologramm-Darstellung (Abbildung 2D) zeigt, wirkten beide Medikamente additiv, um die Replikation dieses ACV-resistenten HSV-Stamms zu hemmen.
 Wirkung von ACV in Kombination mit BILD 1633 SE gegen Wildtyp- und ACV-resistentes HSV in vitro. Ausgewählte Konzentrationen von BILD 1633 SE wurden in Kombination mit verschiedenen Dosen von ACV getestet, und die EC50s für HSV KOS, F, PAAr5 und dl sptk wurden durch den ELISA-basierten antiviralen Assay wie in Materialen und Methoden beschrieben bestimmt.
Wirkung von ACV in Kombination mit BILD 1633 SE gegen Wildtyp- und ACV-resistentes HSV in vitro. Ausgewählte Konzentrationen von BILD 1633 SE wurden in Kombination mit verschiedenen Dosen von ACV getestet, und die EC50s für HSV KOS, F, PAAr5 und dl sptk wurden durch den ELISA-basierten antiviralen Assay wie in Materialen und Methoden beschrieben bestimmt.
Monotherapie mit BILD 1633 SE oder ACV gegen HSV-1 PAAr5-Infektion.
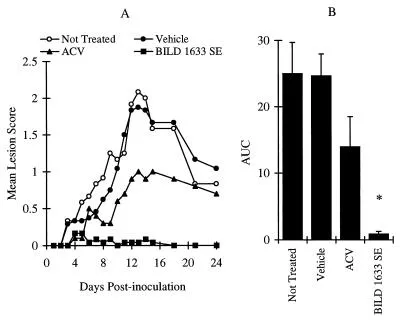
Wie in Abbildung 3 gezeigt, induzierte die Inokulation von Mäusen mit 106 PFU HSV-1 PAAr5 pro Stelle moderate Läsionen mit einem maximalen Läsionswert von 2,1 ± 0,4 am Tag 13 nach der Inokulation (Abbildung 3A). Die Behandlung mit Vehikel hatte keinen Einfluss auf den maximalen Läsionswert oder den AUC-Wert (Abbildung 3A und B). Die topische Behandlung mit 5% ACV reduzierte den maximalen Läsionswert (P < 0,05), aber die Wirkung auf den AUC-Wert erreichte keine statistische Signifikanz (P > 0,05). Im Gegensatz dazu beseitigte die Behandlung mit 5% BILD 1633 SE fast vollständig topische Läsionen (Abbildung 3A und B). Weitere Informationen zu Gymnastik finden Sie unter rhythmische sportgymnastik anfänger.
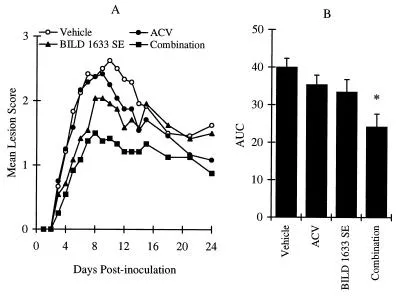
Die Erhöhung des Virusinokulums auf 107 PFU pro Inokulationsstelle induzierte stärkere topische Läsionen, die am Tag 13 nach der Inokulation einen maximalen Läsionswert von 2,9 ± 0,3 erreichten (Abbildung 4A und B). Die Behandlung mit 5% topischem ACV für 10 Tage reduzierte sowohl den maximalen Läsionswert auf 1,4 ± 0,3 als auch den AUC-Wert um 45% (P < 0,05). Die topische Behandlung infizierter Mäuse mit 5% BILD 1633 SE reduzierte den maximalen Läsionswert auf 1 ± 0,3 und den AUC-Wert um 66% (P < 0,05). Diese In-vivo-antivirale Wirkung von BILD 1633 SE war hoch reproduzierbar, wie durch drei zusätzliche unabhängige Experimente bestätigt wurde, die Reduktionen der AUC-Werte der Läsionswerte von 60, 81 bzw. 61% zeigten (n = 12 für sowohl die Vehikel- als auch die medikamentenbehandelten Gruppen; P war <0,05 für alle Experimente). Der dosisabhängige Effekt von topischem BILD 1633 SE gegen HSV-1 PAAr5-induzierte topische Läsionen bei athymischen Mäusen ist in Abbildung 4C und D dargestellt.
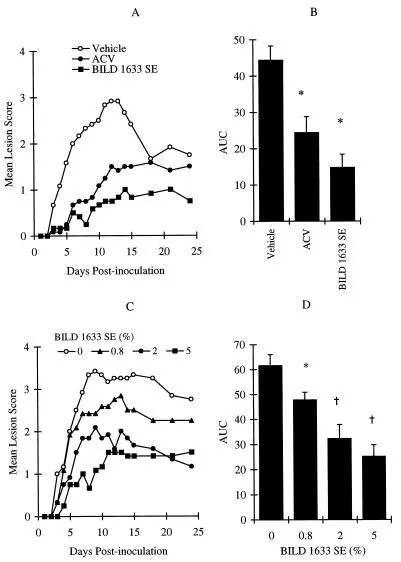 Vergleichende Wirkung von ACV und BILD 1633 SE gegen HSV-1 PAAr5-Infektion. Die Tiere wurden kutan mit 106 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV (5%) und BILD 1633 SE (5%) wurden viermal täglich topisch aufgetragen.
Vergleichende Wirkung von ACV und BILD 1633 SE gegen HSV-1 PAAr5-Infektion. Die Tiere wurden kutan mit 106 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV (5%) und BILD 1633 SE (5%) wurden viermal täglich topisch aufgetragen.
Kombinationstherapie mit oralem ACV und topischem BILD 1633 SE gegen HSV-1 PAAr5-Infektion.
Da die gleichzeitige Verabreichung von zwei Verbindungen auf dem gleichen Weg zu chemischen und/oder physikalischen Wechselwirkungen der Verbindungen führen kann, verabreichten wir ACV und BILD 1633 SE auf zwei verschiedenen Wegen. Abbildung 5 zeigt die Wirkung von oralem ACV, das kontinuierlich im Trinkwasser verabreicht wurde. Als ACV für 10 Tage im Trinkwasser mit einer Konzentration von 1 mg/ml verabreicht wurde, wurde kein Schutz vor HSV-Erkrankung festgestellt (Abbildung 5A und B). Maximaler Schutz wurde jedoch mit einer Konzentration von 3 mg/ml (tägliche Dosis, 871 ± 49 mg/kg Körpergewicht) erreicht, was zu einer Reduktion der AUC des Läsionswertes um 48% führte. Dieser Schutz war ähnlich dem, der mit topischer ACV-Behandlung erreicht wurde, wie oben beschrieben. Die Erhöhung der ACV-Konzentration auf 5 mg/ml im Trinkwasser (tägliche Dosis, 1.391 ± 29 mg/kg) verbesserte den beobachteten Schutz nicht, möglicherweise weil die maximale Wirksamkeit mit der Dosis von 3 mg/ml unter den aktuellen experimentellen Bedingungen erreicht wurde. Bei allen getesteten Dosen veränderte ACV nicht das Verhalten oder das Körpergewicht der behandelten Mäuse. Cardio Training ist beispielsweise durch cardio schwimmen möglich.
Um die Wirksamkeit der Kombinationstherapie bei der Behandlung von HSV-1 PAAr5-induzierten topischen Läsionen zu bestimmen, wurde ACV oral im Trinkwasser mit einer Konzentration von 1,5 mg/ml in Kombination mit 0,8% BILD 1633 SE in einer topischen Creme verabreicht. Wie in Abbildung 6 dargestellt, hatte die Behandlung mit ACV allein keinen signifikanten Einfluss auf die Infektion, während die Behandlung mit BILD 1633 SE allein den mittleren Krankheitswert für 7 Tage ab Tag 4 signifikant reduzierte. Die Kombinationstherapie war wirksamer als die Therapie mit jedem Mittel allein. Wie in Abbildung 6 gezeigt, waren die AUC-Werte und der mittlere Krankheitswert für die Kombination von ACV und BILD 1633 SE an den Tagen 8 bis 11 im Vergleich zu denjenigen für jede Behandlung allein signifikant reduziert.
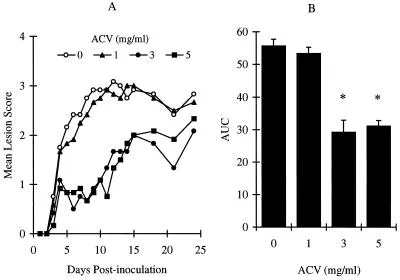 Antivirale Wirkung von ACV im Trinkwasser gegen HSV-1 PAAr5-Infektion. Die Tiere wurden kutan mit 107 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV wurde im Trinkwasser mit 0, 1, 3 und 5 mg/ml gegeben.
Antivirale Wirkung von ACV im Trinkwasser gegen HSV-1 PAAr5-Infektion. Die Tiere wurden kutan mit 107 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV wurde im Trinkwasser mit 0, 1, 3 und 5 mg/ml gegeben.
Monotherapie und Kombinationstherapie mit ACV und BILD 1633 SE gegen HSV-1 dlsptk-Infektion.
Reproduzierbare und persistierende topische Läsionen wurden durch die Inokulation athymischer Nacktmäuse mit 107 PFU HSV-1 dlsptk pro Inokulationsstelle induziert (Abbildung 7). Infizierte Tiere, die keine Behandlung erhielten, hatten einen mittleren maximalen Läsionswert von 3 ± 0,1 am Tag 12 nach der Inokulation, mit einer mittleren AUC über 24 Tage von 50 ± 3 (n = 12). Mit Vehikel behandelte Tiere hatten einen maximalen Läsionswert von 2,8 ± 0,1, mit einer AUC von 50 ± 2 (n = 24; P > 0,05). Die Behandlung mit 5% topischem ACV hatte keinen signifikanten Einfluss auf den maximalen Läsionswert oder den AUC-Wert (Abbildung 7). Die topische Behandlung mit 5% BILD 1633 SE für 10 Tage führte jedoch zu statistisch signifikanten Reduktionen des maximalen Krankheitswertes und des AUC-Wertes (Abbildung 7).
 Antivirale Wirkung von oralem ACV und topischem BILD 1633 SE gegen HSV-1 PAAr5-Infektion. Die Tiere wurden kutan mit 107 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV wurde im Trinkwasser mit einer Dosis von 1,5 mg/ml gegeben. BILD 1633 SE (0,8%) wurde viermal täglich topisch aufgetragen.
Antivirale Wirkung von oralem ACV und topischem BILD 1633 SE gegen HSV-1 PAAr5-Infektion. Die Tiere wurden kutan mit 107 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV wurde im Trinkwasser mit einer Dosis von 1,5 mg/ml gegeben. BILD 1633 SE (0,8%) wurde viermal täglich topisch aufgetragen.
Abbildung 8 zeigt die Wirkung der Kombinationstherapie von oralem ACV mit topischem BILD 1633 SE im Vergleich zur Wirkung der Behandlung mit jedem Mittel allein. Mäuse, die zur mit Vehikel behandelten Gruppe gehörten, hatten einen mittleren maximalen Läsionswert von 2,6 ± 0,1 und eine mittlere AUC von 43 ± 3 (n = 24). Die Behandlung mit oralem ACV mit einer Konzentration von 5 mg/ml im Trinkwasser reduzierte die AUC nur um 19%. Im Vergleich dazu reduzierte die topische Behandlung mit 5% BILD 1633 SE für 10 Tage die AUC um 51% (P < 0,05) (Abbildung 8). Die Kombinationstherapie von oralem ACV (5 mg/ml) und topischem BILD 1633 SE (5% Creme) war wirksamer als die Behandlung mit jedem Mittel allein (Abbildung 8). Nur wenige Tiere in dieser Gruppe entwickelten beobachtbare Vesikel.
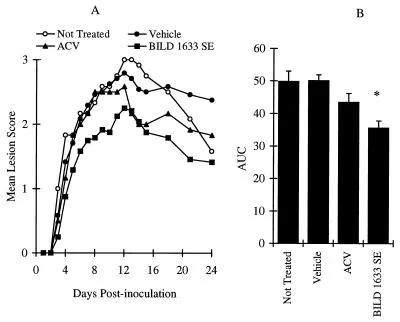 Vergleichende Wirkungen von oralem ACV und topischem BILD 1633 SE gegen HSV-1 dl sptk Infektion. Die Tiere wurden kutan mit 107 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV (5%) und BILD 1633 SE (5%) wurden viermal täglich topisch aufgetragen.
Vergleichende Wirkungen von oralem ACV und topischem BILD 1633 SE gegen HSV-1 dl sptk Infektion. Die Tiere wurden kutan mit 107 PFU/Stelle inokuliert, wie in Materialen und Methoden beschrieben. ACV (5%) und BILD 1633 SE (5%) wurden viermal täglich topisch aufgetragen.
DISKUSSION
Die vorliegende Studie berichtet zum ersten Mal über eine wirksame Therapie gegen ACV-resistente HSV-Infektionen bei athymischen Nacktmäusen mit einem selektiven HSV-RR-Subunit-Assoziationsinhibitor, BILD 1633 SE. Übereinstimmend mit seinen In-vitro-antiviralen Eigenschaften war BILD 1633 SE wirksamer gegen HSV-1 PAAr5-induzierte Läsionen als gegen HSV-1 dlsptk-induzierte Läsionen, mit inokulumabhängigen AUC-Reduktionen von 67 bis 96% bzw. 28 bis 51%. Obwohl BILD 1633 SE weniger wirksam gegen HSV-1 dlsptk-induzierte Infektionen war, sollte darauf hingewiesen werden, dass das Bewertungssystem für topische Läsionen auf subjektiven Kriterien basiert und dass eine 50%ige Reduktion des Krankheitsläsionswertes von 3 auf 1,5 mit einer signifikanten Beseitigung von HSV-induzierter Ulzeration verbunden ist.
Die Hemmung von HSV-RR wurde zuvor als eine mögliche Strategie für die Therapie gegen sowohl ACV-sensitive als auch ACV-resistente HSV-Infektionen vorgeschlagen. Eine signifikante In-vivo-Wirksamkeit spezifischer RR-Inhibitoren gegen ACV-resistente HSV-Infektionen wurde unseres Wissens jedoch nicht berichtet. Spector et al. haben die In-vitro- und begrenzten In-vivo-Antiherpesvirus-Wirkungen von Thiosemicarbazon-Derivaten gezeigt, einer Reihe von Verbindungen, die die Integrität des freien Radikals und/oder des Eisenzentrums der kleinen Untereinheit des Enzyms stören. Da die menschliche RR auch ähnliche chemische Eigenschaften enthält, scheinen diese Verbindungen nicht sehr selektiv gegen HSV-RR zu sein. Darüber hinaus scheint die In-vivo-Wirksamkeit dieser Klasse von RR-Inhibitoren auf die Verstärkung der Wirkungen von ACV beschränkt zu sein, anstatt als wirksame monotherapeutische Antiherpesvirus-Mittel zu wirken. In einer anderen Studie haben Bridges et al. die Möglichkeit untersucht, kutane HSV-Infektionen mit einem Inhibitor der Säugetier-RR, MDL 101731, zu behandeln. Obwohl diese Forscher die starke In-vitro-Aktivität dieser Verbindung gegen sowohl ACV-sensitives als auch ACV-resistentes HSV zeigten, konnten sie keine In-vivo-Aktivität gegen ACV-resistente HSV-Infektionen beobachten. Das Fehlen der Wirksamkeit dieser Mittel als Monotherapie wurde zum Teil auf eine schlechte Gewebepenetration und auf die Tatsache zurückgeführt, dass die virale RR bei diesen Infektionen aufgrund erhöhter Desoxynukleosidtriphosphat (dNTP)-Pools entbehrlich sein könnte. Unsere Ergebnisse zeigen deutlich, dass spezifische HSV-RR-Inhibitoren als Monotherapie im athymischen Nacktmausmodell wirksam sind, was impliziert, dass die virale RR für die Pathogenese in diesem Modell
