Die zunehmende Forderung nach Anwendungsentwicklungen und einem breiteren Einsatz von Künstlicher Intelligenz (KI) in der Medizin prägt die Diskussion über die Zukunft der Gesundheitsversorgung. Das zentrale Ziel dieser Entwicklung ist es, Gesundheitsdaten effizient, präzise und qualitativ hochwertig auszuwerten, um die Patientenversorgung nachhaltig zu verbessern. Angesichts des demografischen Wandels, der mit einer steigenden Krankheitslast in der Bevölkerung und einem sich verschärfenden Fachkräftemangel einhergeht, bieten KI-Technologien das immense Potenzial, Prävention, Diagnostik und Therapie maßgeblich zu optimieren. Die rasante Entwicklung von KI in anderen Sektoren und ihre wachsende Adaption im Gesundheitswesen werfen jedoch entscheidende Fragen bezüglich bestehender Herausforderungen und potenzieller Lösungsansätze auf. Trotz der weitreichenden Möglichkeiten stellt sich daher die Kernfrage: Warum wurden KI-Technologien im Gesundheitswesen bisher nicht umfassend genutzt?
Spätestens seit der Entwicklung leistungsfähiger KI-Grundlagenmodelle – insbesondere großer Sprachmodelle (Large Language Models, LLMs) und sogenannter Foundation Models, die als breit einsetzbare Basismodelle für verschiedenste Aufgaben dienen – ist der kontinuierlich wachsende Einfluss von KI auf nahezu alle Arbeitsbereiche und Alltagsprozesse unverkennbar. Bereits 2019 legte OpenAI mit der Veröffentlichung des Sprachmodells GPT-2 den Grundstein für die Generierung von Content, Übersetzungsdiensten und Chatbots in einer zuvor unvorstellbaren Qualität. Doch woran liegt die vergleichsweise schleppende Adaption dieser fortschrittlichen KI-Technologien im Gesundheitsbereich? Technische Entwicklungen benötigen große Mengen an Trainingsdaten. Deren Generierung ist in der Industrie oder für Anwendungen wie die Bildanalyse häufig unproblematisch. Gesundheitsdaten unterliegen hingegen nicht nur strengen Datenschutzbestimmungen, sondern werden zudem in heterogenen klinischen Systemen erzeugt und gespeichert. Überwiegende Probleme bei Standardisierung, Strukturierung und Interoperabilität verhindern oft eine spätere Datenaggregation. Eine erfolgreiche Entwicklung von KI in der Medizin bezog sich daher bisher zumeist auf die monozentrische Nutzung von Daten einzelner Kliniken oder Krankenhäuser, wie zum Beispiel die Auswertung radiologischer Bilddaten. In der Radiologie wurde beispielsweise bereits vor über 30 Jahren der DICOM-Standard international eingeführt, wodurch standardisierte Trainingsdaten zur Verfügung standen, die die Entwicklung zahlreicher KI-gestützter Bildauswertungstools erst ermöglichten.
Während die ersten KI-Systeme noch mit wenigen Tausend Datensätzen trainiert wurden, erfordert die Entwicklung generativer KI heutzutage Datenmengen im Terabyte-Bereich. Die fortschreitende Digitalisierung führt zu einem exponentiellen Anstieg von Gesundheitsdaten und treibt damit die Weiterentwicklung von KI-Applikationen voran, deren Einsatz jedoch an eine interoperable Datennutzung gebunden ist. Datenstruktur und -verfügbarkeit sind somit entscheidend für die erfolgreiche Entwicklung und Implementierung von KI-Technologien in der Medizin. Historisch verzögerte sich diese Entwicklung aufgrund des gesetzlichen Schutzes von Gesundheitsdaten und der langsamen Digitalisierung im medizinischen Bereich. Zudem erschwert das Fehlen einer gemeinsamen Dateninfrastruktur, -standardisierung und -aggregation den Fortschritt erheblich. Datengetriebene, lernende Systeme könnten jedoch komplexe Krankheitsprognosen und eine zielgerichtete Therapieunterstützung leisten, wenn sie Informationen aus unterschiedlichen Datenquellen – wie Krankheitsverlauf, Bilddatenanalyse, medikamentöse Therapie, klinische Symptomatik und neueste wissenschaftliche Erkenntnisse – miteinander kombinieren könnten. Würde die Vorbedingung einer interoperablen Nutzung von Daten aus verschiedenen klinischen Systemen und gegebenenfalls Gesundheitssektoren erfüllt, könnte ein bahnbrechender Fortschritt in Richtung einer personalisierten Präzisionsmedizin erfolgen. Dieser Beitrag beleuchtet einerseits die historische Entwicklung von KI in der Medizin und geht andererseits der Frage nach, wieso in Deutschland eine umfassende Nutzung bisher nicht stattgefunden hat beziehungsweise wo die Herausforderungen liegen, deren Bewältigung KI-Technologien zum „Gamechanger“ im Gesundheitswesen werden lassen könnte.
Historische Entwicklung und Meilensteine der KI-Technologien im Gesundheitswesen
Die Entwicklung der KI-Technologien im Gesundheitswesen erstreckt sich von den Anfängen regelbasierter Expertensysteme bis hin zu modernen Ansätzen des maschinellen Lernens (ML) und tiefen Lernens (Deep Learning, DL). Diese Transformation ist von bedeutenden Meilensteinen und einer kontinuierlichen zeitlichen Entwicklung geprägt.
Die ersten Anwendungen von KI-Technologien im Gesundheitswesen entstanden bereits in den 1960er-Jahren. Ein frühes und prägnantes Beispiel aus dieser Zeit ist der erste entwickelte Chatbot „Eliza“, der einfache psychotherapeutische Gespräche simulierte und damit die Grundlagen der natürlichen Sprachverarbeitung demonstrierte. Insgesamt sind die Anfänge der KI-Entwicklung maßgeblich von sogenannten Expertensystemen geprägt. Diese computergestützten Systeme basieren auf festen, regelbasierten Entscheidungsprozessen und wurden speziell konzipiert, um medizinisches Fachpersonal bei der Diagnosestellung und Therapieplanung zu unterstützen. Eines der ersten Expertensysteme, entstanden in den frühen 1970er-Jahren, ist „MYCIN“, ein System, das Infektionskrankheiten diagnostizierte und therapeutische Vorschläge für die Antibiotikabehandlung lieferte. Ein weiteres wegweisendes Expertensystem aus den 1970er-Jahren war „CASNET“, ein kausal-assoziatives Netzwerk, das für die Diagnose und Behandlung von Glaukom entwickelt wurde und Ärzten strukturierte Entscheidungshilfen bot.
In den 1980er-Jahren führte die steigende Verfügbarkeit medizinischer Daten zur Entwicklung wichtiger Standards wie DICOM (Digital Imaging and Communications in Medicine), der die standardisierte Verarbeitung medizinischer Bilddaten ermöglichte und somit die Grundlage für Anwendungen in der Bildverarbeitung schuf. Zeitgleich wurde mit der Einführung datengetriebener Ansätze „DXplain“ veröffentlicht, ein Entscheidungsunterstützungssystem, das den Übergang von regelbasierten zu datengetriebenen Ansätzen in der klinischen Entscheidungsfindung markierte. Es lieferte auf Grundlage eingegebener Symptome eine differenzialdiagnostische Einschätzung und diente als elektronisches medizinisches Nachschlagewerk. Ende der 1980er-Jahre erweiterten „Convolutional Neural Networks“ (CNNs) die KI-Forschung erheblich. Als bahnbrechender Fortschritt in der automatisierten Bildanalyse ermöglichten CNNs erstmals eine effektive Verarbeitung komplexer visueller Datenstrukturen und fanden später insbesondere Anwendung bei der Tumorerkennung sowie der computergestützten diagnostischen Entscheidungsunterstützung. „AlexNet“, das im Jahr 2012 publiziert wurde, markierte einen entscheidenden Durchbruch in der Bildklassifikation, indem es als erstes tiefes CNN herausragende Ergebnisse erzielte und damit die Leistungsfähigkeit moderner KI-Technologien in diesem Bereich unter Beweis stellte.
Seit den 2000er-Jahren führten Fortschritte im Deep Learning und dem „Natural Language Processing“ (NLP) einen Paradigmenwechsel in der medizinischen KI-Forschung herbei. NLP-Modelle ermöglichten die automatisierte Analyse medizinischer Texte, was ein enormes Potenzial für die Auswertung von Arztbriefen und die Kodierung von Diagnosen eröffnete. Auch im Bereich der Bilddatenanalyse entwickelten sich KI-Technologien kontinuierlich weiter. „Arterys“ erhielt 2017 als erste klinische Cloud-basierte Deep-Learning-Anwendung die Zulassung der US-amerikanischen Food and Drug Administration (FDA) – zunächst für die Analyse von kardialen Magnetresonanztomografien (MRT). Später wurde die Anwendung auf die Auswertung von Computertomografien (CT) der Leber, der Lunge und des Kopfes sowie auf Röntgenaufnahmen und andere bildgebende Verfahren ausgeweitet. Im gleichen Jahr wurde „IBM Watson“, ein KI-System mit natürlicher Sprachverarbeitung und Datenanalysefähigkeiten, genutzt, um RNA-bindende Proteine zu identifizieren, die bei amyotropher Lateralsklerose (ALS) eine entscheidende Rolle spielen. Mit der Veröffentlichung des Papers „Attention is All You Need“ im Jahr 2017 leitete das Transformer-Modell einen fundamentalen Umbruch im Bereich des NLP ein. Es ersetzte herkömmliche sequenzielle Architekturen durch ein auf Attention-Mechanismen basierendes Modell, das erstmals eine flexible und kontextabhängige Verarbeitung von Texten in großem Maßstab ermöglichte. Aufbauend auf diesem Prinzip entstanden leistungsstarke „Large Language Models“ (LLMs) wie „BERT“ und „GPT“, die nicht nur das NLP nachhaltig veränderten, sondern auch weitreichende neue Anwendungsmöglichkeiten für KI-Technologien in der medizinischen Praxis eröffneten.
Seit den 2020er-Jahren hat die Weiterentwicklung von Foundation Models, wie „GPT-3“, das Potenzial der KI-Technologien im Gesundheitswesen deutlich erweitert. Foundation Models bezeichnen großskalige, vortrainierte KI-Modelle, die als universelle Grundlage für eine Vielzahl spezifischer Anwendungen dienen; sie umfassen unter anderem LLMs und unterscheiden sich von klassischen, domänenspezifischen Modellen durch ihre Vielseitigkeit und Adaptionsfähigkeit. Diese Modelle besitzen das Potenzial, große, heterogene Datensätze zu analysieren und Ärzte bei Diagnose und Therapieplanung zu unterstützen, indem sie medizinische Fachliteratur, Patientenakten und medizinische Leitlinien miteinander verbinden können. Zudem ermöglichen sie die Integration verschiedener Datenquellen, darunter Bild-, Text- und Genomdaten, in einheitliche klinische Entscheidungssysteme. Durch diese Fortschritte können komplexe Zusammenhänge im medizinischen Kontext greifbarer gemacht werden und bieten die Grundlage für neue Möglichkeiten in der personalisierten und präzisen Gesundheitsversorgung. Der Einsatz von Foundation Models im klinischen Kontext steht noch am Anfang und stellt bislang ein enormes Anwendungspotenzial dar, das durch regulatorische Vorgaben begrenzt ist. Die Geschichte der KI-Technologien im Gesundheitswesen ist somit durch bedeutende technologische Fortschritte geprägt, die eine Integration moderner Ansätze in klinische Arbeitsabläufe versprechen. Die Überführung von Forschungsergebnissen in die klinische Praxis stellt jedoch weiterhin eine zentrale Herausforderung dar.
Arten von KI-Technologien und ihre Anwendung im Gesundheitswesen
Im Gesundheitswesen finden verschiedene Arten von KI-Technologien Anwendung, die transformative Auswirkungen auf die Bereiche Prävention, Diagnose, Therapie und Administration haben. Eine wesentliche Rolle spielt dabei das maschinelle Lernen (ML), welches sich in drei Hauptkategorien unterteilen lässt: „Unsupervised Learning“ (unüberwachtes Lernen) findet Anwendung in der Mustererkennung, etwa zur Ableitung unbekannter Zusammenhänge aus großen, unstrukturierten Datenmengen. Beim „Supervised Learning“ (überwachtes Lernen) werden gelabelte Daten genutzt, um Klassifikationsprobleme wie die Differenzierung von Krankheitsbildern zu lösen. „Reinforcement Learning“ (verstärkendes Lernen) basiert auf Belohnungsmechanismen und findet insbesondere in der Robotik Anwendung, wo es autonome Entscheidungsprozesse ermöglicht.
Des Weiteren lässt sich eine Kategorisierung von KI-Technologien im Gesundheitswesen nach ihrem Fokus vornehmen, wobei eine Differenzierung zwischen schwacher und starker KI erfolgt. Gegenwärtig liegt der Schwerpunkt auf spezialisierter, schwacher KI, die für spezifische Aufgaben optimiert ist, während starke KI, die allgemeine menschliche Intelligenz umfassen würde, eine Vision für die Zukunft darstellt. Innerhalb der schwachen KI im medizinischen Anwendungsbereich lassen sich vier Haupttypen unterscheiden: präventive, diagnostische, KI-gestützte Therapie und administrative KI.
Die präventive KI zielt darauf ab, Krankheiten frühzeitig zu erkennen und ihre Entstehung zu verhindern. Durch den Einsatz fortschrittlicher Algorithmen sind eine präzise Analyse von Risikofaktoren, die Entwicklung personalisierter Präventionsmaßnahmen sowie die frühzeitige Erkennung genetischer oder individueller Risikokonstellationen möglich, um präventiv im symptomfreien Frühstadium eingreifen zu können. Die Verwendung von KI-unterstützten EKG-Systemen (AI-ECG) ermöglicht beispielsweise die frühzeitige Erkennung von Herzpathologien sowie die Prognose von Überlebensraten. Eine Übersichtsarbeit aus dem Jahr 2021 zeigt anhand von über 3,8 Millionen Patientendaten das enorme Potenzial präventiver KI für die frühe Krebsdiagnose durch Risikostratifizierung und Symptomanalyse in der Primärversorgung – ein wichtiger Schritt hin zur Etablierung KI-gestützter Vorsorgestrategien.
Die diagnostische KI erweitert die medizinische Diagnostik, indem sie Krankheiten präzise und effizient erkennt. Der Einsatz von KI-Technologien erlaubt eine Beschleunigung diagnostischer Prozesse und eine signifikante Steigerung der Genauigkeit von Diagnosen, insbesondere wenn verschiedene Datenquellen kombiniert und somit präzise Entscheidungsunterstützungssysteme entwickelt werden können. Darüber hinaus kann KI auch in Bereichen wie multimodaler Gerätesteuerung, Robotik sowie virtueller und erweiterter Realität zur Unterstützung diagnostischer Verfahren eingesetzt werden, etwa durch die Navigation bei bildgestützten Eingriffen oder die Visualisierung komplexer Daten für die Entscheidungsfindung. Ein prominentes Beispiel diagnostischer KI ist die multimodale Überlebensprognose bei Bauchspeicheldrüsenkrebs, die durch die Kombination klinischer, bildgebender und genetischer Daten präzisere Vorhersagen als traditionelle Methoden ermöglicht. Eine Analyse von 83 Studien zeigt, dass generative KI-Modelle eine geringere diagnostische Genauigkeit als Experten, jedoch vergleichbare Ergebnisse mit Nichtexperten erzielen. Dies unterstreicht ihr Potenzial als unterstützendes Werkzeug in klinischen Entscheidungssituationen, insbesondere in ressourcenschwachen oder nichtspezialisierten Kontexten.
Der Einsatz KI-gestützter Therapie eröffnet neue Möglichkeiten zur individualisierten und effektiveren Behandlung von Patienten. Durch innovative Algorithmen kann eine bessere Abstimmung von Therapien auf die individuellen Bedürfnisse von Patienten gewährleistet werden, was zu optimierten Behandlungsergebnissen führt. Gleichzeitig tragen diese KI-Technologien zur effizienteren Nutzung medizinischer Ressourcen und zur Verbesserung der Versorgungsqualität bei, beispielsweise ein Deep-Learning-Modell, welches personalisierte Risikoprognosen für Thrombozytentransfusionen erstellt, wodurch die Ressourcenplanung optimiert und Versorgungsengpässe verhindert werden können. Eine Metaanalyse randomisierter Studien zeigt, dass multimodale, mobil integrierte und generative KI-Chatbots Symptome von Depression und Stress signifikant reduzieren und dabei mittlere bis große Effekte erzielen.
Die Implementierung von KI im administrativen Sektor des Gesundheitswesens führt zu einer Transformation der organisationalen und logistischen Strukturen medizinischer Einrichtungen. Der Einsatz intelligenter Systeme erlaubt eine optimierte Gestaltung von Arbeitsabläufen, eine effiziente Nutzung von Ressourcen sowie eine solidere Grundlage für strategische Entscheidungen. Dies fördert eine Steigerung der Qualität und Wirtschaftlichkeit der Gesundheitseinrichtungen. Die KI-gestützte Krankenhausverwaltung kann dem Management Prognosen und Analysen zur Verfügung stellen, beispielsweise zur Bettenbelegung oder Personalplanung. Dadurch werden strategische Entscheidungen optimiert und Ressourcen effektiver eingesetzt. Eine systematische Übersichtsarbeit analysiert 70 Studien, weist jedoch darauf hin, dass quantitative Aussagen zur Effektivität von KI-Anwendungen im administrativen Gesundheitswesen bislang selten sind und weitere Forschung erfordern.
Herausforderungen und Limitationen für KI-Technologien in der Medizin
Der Einsatz komplexer KI-Technologien wirft zahlreiche neue ethische und soziotechnische Fragen auf. Kritische Punkte sind zum Beispiel die fehlende Transparenz und Nachvollziehbarkeit, die zu sogenannten „Blackbox“-Problemen führen können. Hierbei lässt sich für Außenstehende nicht mehr nachvollziehen, wie das KI-Modell zu seinem Ergebnis gekommen ist. Diese Blackbox-Problematik kann auch die Zuschreibung moralischer Verantwortung beeinflussen. Dem medizinischen Personal die volle moralische Verantwortung für nicht erkannte Fehler einer KI zuzuweisen, scheint problematisch, da zur Erkennung von KI-Fehlern ein immer komplexer werdendes technisches Verständnis notwendig ist.
Zurzeit ist das ärztliche Personal dazu angehalten, stets eine Plausibilitätsprüfung der durch die KI ermittelten Ergebnisse durchzuführen. Inwiefern sich diese Forderung langfristig aufrechterhalten lässt, ist fraglich. Zum einen besteht das Risiko eines „Automation Bias“. Hierbei werden die Vorhersagen des KI-Modells ohne weitere Überprüfung als richtig angesehen und als Basis für weitere Handlungen genommen. Mögliche Fehler der KI werden dabei nicht mehr in Betracht gezogen. Eine Möglichkeit, dem Automation Bias zu begegnen, kann „Explainable AI“ sein. Wenn diese KI-Technologien ihre jeweiligen Quellen oder Berechnungsschritte laienverständlich darstellen, ist es einfacher, deren Ergebnisse auf Fehler zu prüfen. Zum anderen besteht langfristig die Gefahr eines Fähigkeitsverlusts bei Gesundheitsfachkräften, wenn KI-Modelle zunehmend medizinisch-technische Tätigkeiten übernehmen. Der damit einhergehende Verlust ärztlichen Erfahrungswissens könnte nicht nur die Überprüfung von KI-Ergebnissen erschweren, sondern auch das Arzt-Patienten-Verhältnis beeinträchtigen. Viele moderne Berufsfelder, auch jenseits der Medizin, werden durch den Fortschritt der Technik umgestaltet; dies betrifft unter anderem die lebensmitteltechnologie berufe, wo Automatisierung und datengesteuerte Prozesse ebenfalls neue Anforderungen an Fachkräfte stellen.
Darüber hinaus bringt der Einsatz von KI-Technologien in der Medizin zahlreiche weitere ethische und soziotechnische Herausforderungen mit sich, deren Diskussion in diesem Rahmen nur angerissen werden kann. Hierzu zählen beispielsweise die Akzeptanz von KI im Behandlungsprozess seitens des Fachpersonals und der Patienten, eine mögliche Dehumanisierung der medizinischen Profession durch die bloße Kategorisierung von Daten oder Fragen der gerechten Verteilung von Ressourcen zur Finanzierung von KI-Entwicklung und herkömmlicher medizinischer Forschung.
Neben den ethischen und soziotechnischen Herausforderungen, die der Einsatz komplexer KI-Modelle in der Medizin mit sich bringt, ergeben sich auch regulatorische Herausforderungen. In seiner aktuellen Form steht der „Artificial-Intelligence-Act“ (AI-Act) der Europäischen Union (EU) in einem Spannungsverhältnis zur Datenschutzgrundverordnung (DSGVO) und der Medical-Device-Regulation (MDR) im medizinischen Bereich. So verbietet die DSGVO beispielsweise die Verarbeitung sensibler Daten wie Religionszugehörigkeit, Alter und ethnische Herkunft, während der AI-Act die Verarbeitung der Daten in Ausnahmefällen gestattet, was zu potenziellen Konflikten führen kann.
Die Zulassung unter der MDR ist die Voraussetzung für die Anwendung eines KI-Modells in der Medizin. Sobald eine KI-Anwendung sowohl durch den AI-Act als auch durch die MDR als Hochrisikoanwendung eingestuft ist, müssen die Anforderungen beider Verordnungen erfüllt werden. Da nicht klar ist, ob eine der beiden Verordnungen vorrangig vor der anderen zu beachten ist, kommt es zu Unsicherheiten und doppelter Zertifizierungs- und Dokumentationsarbeit. Außerdem stellen die begrenzten Kapazitäten der zuständigen Zulassungsstellen für neue KI-Modelle die Unternehmen vor erhebliche Herausforderungen.
KI-Technologien in der Medizin sind weiterhin mit einigen technischen Herausforderungen verbunden. Vor allem die Unvermeidbarkeit von „Halluzinationen“ in generativen Modellen (die Ausgabe von Informationen, die faktisch falsch, erfunden oder unbelegt sind) erfordert Risikoabschätzungen, die den praktischen Einsatz insbesondere in hochsensiblen diagnostischen oder therapeutischen Bereichen einschränken können. Weitere kritische Aspekte sind der Bias in Trainingsdaten, der die Übertragbarkeit und Generalisierbarkeit der Modelle beeinträchtigt, sowie die erheblichen Herausforderungen hinsichtlich der Implementierungs- und Betriebskosten. Im Gegensatz dazu bieten wissens- und logikbasierte KI-Ansätze inhärente Vorteile in Bezug auf Erklärbarkeit, Nachvollziehbarkeit und technische Anforderungen. Daher ist eine sorgfältige Abwägung zwischen Deep-Learning-Ansätzen und klassischen regelbasierten Ansätzen in individuellen medizinischen Kontexten sinnvoll.
Eine weitere wesentliche Herausforderung für KI-Technologien in der Medizin ist die anhaltende Fragmentierung von Gesundheitsdaten durch die bestehenden Datensilos. Hinzu kommt eine fehlende Standardisierung, obwohl mit der Gesundheits-IT-Interoperabilitäts-Governance-Verordnung klare Vorgaben zur Förderung von semantischer und syntaktischer Interoperabilität in Deutschland bestehen. Diese ließe sich beispielsweise auf bereits zur Verfügung stehenden international anerkannten Standards aufbauen. Die fehlende Interoperabilität der Daten und die bestehenden Datensilos wirken sich nachteilig auf die Verfügbarkeit von Trainingsdaten für die KI-Entwicklung aus. Auch die konkrete Anwendbarkeit von KI-Anwendungen kann in Mitleidenschaft gezogen werden, wenn beispielsweise unterschiedliche Gesundheitsdaten aus unterschiedlichen Silos kombiniert werden müssen. Weitere Probleme ergeben sich für KI-Anwendungen, wenn Daten nur in unstrukturierter Form vorliegen. Wünschenswert wäre daher die Harmonisierung der heterogenen Gesundheitsdatensets durch einheitliche Datenstandards wie „Fast Healthcare Interoperability Resources“ (FHIR). Darüber hinaus sollten internationale Nomenklaturen wie „SNOMED CT“ und „LOINC“ umgesetzt werden, um die semantische und syntaktische Interoperabilität der Daten sicherzustellen und das volle Potenzial der KI-Technologien zu entfalten.
Erfolgsmodell: Das „Smart Hospital“ als Wegweiser für KI-Technologien
Die Universitätsmedizin Essen (UME) verfolgt seit 2015 das innovative Konzept eines „Smart Hospital“ und gilt als herausragendes Beispiel für eine erfolgreiche Umsetzung der Digitalisierung im Gesundheitswesen. Ziel ist die nachhaltige Verbesserung der Patientenversorgung durch intelligente, digitale Vernetzung klinischer Prozesse. Im Rahmen dieser ambitionierten Strategie wurden die wegweisenden Projekte „Smart Hospital Information Platform“ (SHIP) und „KI-Translation Essen“ (KITE) initiiert. SHIP dient dabei als Referenzarchitektur für die Integration von Gesundheitsdaten, während KITE darauf abzielt, KI-Technologien aktiv in den klinischen Alltag zu überführen. Beide Projekte sind, wie im Schichtenmodell des Smart Hospital Essen dargestellt, stark miteinander verzahnt und optimal aufeinander abgestimmt.
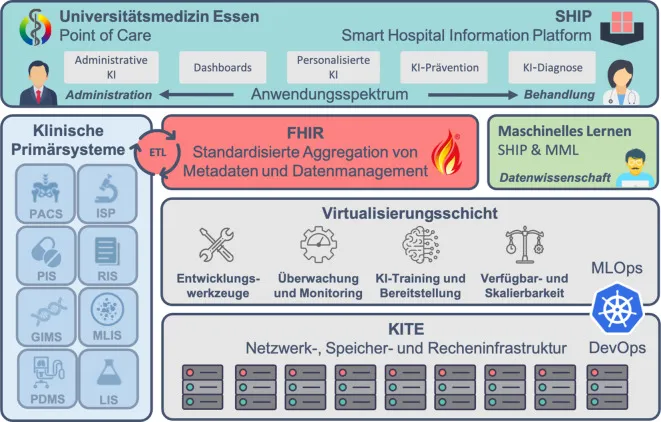 Schichtenmodell des Smart Hospital Essen
Schichtenmodell des Smart Hospital Essen
Als standardisiertes Architekturmodell bietet SHIP einen umfassenden Referenzrahmen für die Entwicklung und Implementierung interoperabler Systeme im Gesundheitswesen. Durch branchenspezifische Best Practices schafft SHIP ein gemeinsames Verständnis von Prozessen, Datenstrukturen und zugrunde liegenden KI-Technologien. Klinische Primärsysteme wie PACS, RIS oder PDMS werden – entsprechend den Interoperabilitätsstandards der Medizininformatik-Initiative (Kerndatensatz) – mittels FHIR, einem international anerkannten Standard für den Austausch medizinischer Daten, standardisiert aggregiert. Anfang 2025 verzeichnet die hauseigene FHIR-Plattform über 1,6 Billionen Ressourcen und verwaltet mehr als 1,5 Millionen Patienten, wobei täglich neu hinzukommende 600.000 Ressourcen integriert werden. Die lokale IT-Infrastruktur (On-Premise-Infrastruktur) von KITE unterstützt die Anwendung moderner Entwicklungspraktiken wie „DevOps“ (Development and Operations – Integration von Softwareentwicklung und IT-Betrieb) und „MLOps“ (Machine Learning Operations – Integration von maschinellem Lernen in Entwicklungs- und Betriebsprozesse). Diese Ansätze sind entscheidend für die kontinuierliche Entwicklung, Bereitstellung und Wartung von Software und KI-Modellen, um die Einsatzfähigkeit der KI-Technologien im klinischen Umfeld zu gewährleisten. Die Teams von SHIP und MML (Medical Machine Learning) setzen Forschungsergebnisse direkt in klinische Anwendungen um, die das gesamte Spektrum von der administrativen KI bis hin zur KI-gestützten Diagnose abdecken.
Trends und zukünftige Entwicklungen von KI-Technologien
In den letzten zehn Jahren wurden auf dem Gebiet des maschinellen Lernens erhebliche Fortschritte erzielt, vor allem durch die Entwicklung von spezialisierten Modellen. So können beispielsweise Bildmodelle radiologische Aufgaben wie die Erkennung von Lungenentzündungen oder Tumoren mit einer hohen Präzision lösen. Dennoch stoßen diese spezialisierten Ansätze in der Praxis an Grenzen, die ihre Einsatzmöglichkeiten einschränken und die Weiterentwicklung von KI-Technologien notwendig machen.
Ein zentrales Problem besteht darin, dass KI-Modelle häufig isoliert arbeiten und keine Informationen aus anderen Modalitäten, wie Textdaten aus elektronischen Patientenakten, genetische Daten oder Laborergebnisse, in ihre Analysen einbeziehen. Zudem fehlt spezialisierten Modellen die Fähigkeit, dynamisch Entscheidungen zu treffen, etwa welches spezialisierte Modell für eine spezifische Aufgabe herangezogen werden sollte. Um Ärzte effektiv zu unterstützen, müsste eine KI flexibel auf Rückfragen eingehen können und eigenständig komplexere Aufgabenstellungen in lösbare Unteraufgaben einteilen.
Mögliche Lösungen zeichnen sich durch den Einsatz von Foundation-Modellen und Agenten ab. Foundation-Modelle ermöglichen multimodales Lernen, indem sie Daten aus verschiedenen Quellen – etwa Text, Bilder und Genomik – integrieren und ganzheitlich analysieren können. LLM-basierte Agenten könnten zudem komplexe Aufgaben orchestrieren, indem sie nicht nur angemessene Modelle für spezifische Aufgaben auswählen, sondern auch eine intuitive Mensch-Maschine-Interaktion ermöglichen. Diese Kombination aus fortschrittlichen KI-Technologien könnte die Effizienz klinischer Prozesse erheblich steigern, die Arbeitsbelastung von Ärzten reduzieren und die Qualität der Patientenversorgung verbessern.
Ein integriertes KI-System aus Foundation-Modellen und Agenten könnte beispielsweise in der Notfallmedizin helfen, indem es alle verfügbaren Informationen wie Anamnese, Laborwerte und bildgebende Verfahren integriert. Der Agent steuert die Modelle, beispielsweise zur Analyse von Röntgenaufnahmen auf Lungenerkrankungen und der Patientenakte zur Identifikation von Risikofaktoren. Er konsolidiert die Ergebnisse und schlägt eine vorläufige Diagnose oder weitere Untersuchungen vor, wobei er dem medizinischen Personal für Rückfragen zur Verfügung steht. Die Evaluation spezialisierter KI ist durch klar definierte Aufgaben und Datensätze vergleichsweise einfach, während die Bewertung vielseitiger Agenten komplex bleibt und häufig manuelle Expertenprüfung erfordert. In der Zukunft wird entscheidend sein, neue und effizientere Methoden zur Evaluation solcher vielseitigen Systeme zu entwickeln, um das volle Potenzial dieser KI-Technologien sicher ausschöpfen zu können.
Diskussion und Fazit: Die Rolle von KI-Technologien für die Zukunft der Medizin
Die historische Entwicklung der KI-Technologien zeigt eine beeindruckende Transformation von der grundlegenden Forschung hin zur praktischen Anwendung im medizinischen Kontext. Aktuelle Trends verdeutlichen die unumgängliche Bedeutung von KI in Schlüsselbereichen wie Diagnostik, Therapie, Prävention und Administration. Trotz dieser vielversprechenden Potenziale stehen der umfassenden Integration von KI-Technologien jedoch erhebliche Herausforderungen gegenüber, die es zu überwinden gilt. Zukünftige Forschung und Entwicklung sollten sich daher verstärkt auf die Schaffung interoperabler Standards, die nahtlose Implementierung KI-gestützter Systeme in die klinische Routine und die Überwindung bestehender Barrieren wie Datensilos und komplexer regulatorischer Rahmenbedingungen konzentrieren.
Ein zentraler Fokus liegt auf der Verbesserung der Datenqualität und der Interoperabilität, um eine nahtlose Integration verschiedener medizinischer Datentypen wie Bildgebung, Genomdaten und klinische Freitexte zu ermöglichen. Fortschritte in diesen Bereichen sind essenziell, um die Leistungsfähigkeit KI-gestützter Systeme zu steigern und eine umfassende Unterstützung in der Diagnostik, Therapie und Prävention zu gewährleisten. Nationale Datenregister und standardisierte Rahmenbedingungen könnten den Austausch zwischen verschiedenen Sektoren fördern und somit eine solide Grundlage für die Entwicklung und Anwendung von KI-Technologien schaffen. Initiativen wie der „European Health Data Space“ dienen als beispielhafte Ansätze, um eine vernetzte und sichere Nutzung von Gesundheitsdaten auf europäischer Ebene zu ermöglichen. Diese Reformen und Infrastrukturverbesserungen sind unerlässlich, um Datenbarrieren zu überwinden und die Potenziale von KI in der medizinischen Versorgung voll auszuschöpfen. Ein wichtiger Schritt hin zu einer solchen Infrastruktur ist die Ende April 2025 eingeführte, standardisierte und interoperable elektronische Patientenakte (ePA). Diese hat das Potenzial, die derzeitige Fragmentierung der Gesundheitsdatenlandschaft zu überwinden. Eine strukturierte ePA als zentraler Datenspeicher würde die notwendige Grundlage für innovative KI-Anwendungen zur effizienteren und personalisierten Versorgung schaffen.
Die Weiterentwicklung der KI-Technologien im Gesundheitswesen zielt auf eine sichere und effektive Integration ab. Ein zentraler Schwerpunkt liegt dabei auf der Verbesserung der Erklärbarkeit und Transparenz von KI-Modellen, um ihre Entscheidungsprozesse für Ärzte und Patienten nachvollziehbar zu gestalten. Dies ist essenziell, um Vertrauen in KI-gestützte Systeme zu fördern und deren klinische Akzeptanz zu steigern. Ein weiterer Fokus liegt auf der Weiterentwicklung und Implementierung ethischer Leitlinien, die Aspekte wie den Schutz von Patientendaten, algorithmische Fairness und die Vermeidung von Diskriminierung adressieren. Der Fokus auf diese Themen gewährleistet eine verantwortungsvolle und gerechte Anwendung von KI-Technologien zum Wohle der Gesellschaft.
Zusammenfassend lässt sich festhalten, dass Künstliche Intelligenz ein erhebliches Potenzial zur Verbesserung der Versorgungsqualität und -effizienz im Gesundheitswesen birgt. Um dieses Potenzial jedoch voll ausschöpfen zu können, müssen Herausforderungen wie Datenfragmentierung, mangelnde Interoperabilität, algorithmische Verzerrungen und komplexe ethische Fragestellungen proaktiv adressiert werden. Zentrale Voraussetzungen hierfür sind die Entwicklung standardisierter, sicherer Dateninfrastrukturen sowie eine enge und kontinuierliche Zusammenarbeit zwischen klinischer Praxis, Forschung, Industrie und Politik. Zukünftige Entwicklungen wie Foundation Models und die multimodale Datenintegration könnten die Basis für eine noch stärker personalisierte und prädiktive Medizin schaffen. Nur durch diese gemeinsamen Anstrengungen und einen verantwortungsvollen Umgang mit den Möglichkeiten der KI-Technologien kann das volle Potenzial im Gesundheitswesen sicher und nachhaltig ausgeschöpft werden. Wir laden Sie ein, die Entwicklungen und Diskussionen rund um diese spannenden Innovationen aktiv zu verfolgen und sich an der Gestaltung der Medizin von morgen zu beteiligen.
