Impfungen sind seit jeher eine tragende Säule der Prävention und retten unzählige Leben, indem sie uns vor einer Vielzahl von Infektionskrankheiten schützen. Darüber hinaus können sie in manchen Fällen sogar Krebserkrankungen verhindern, wie zum Beispiel bei HPV-assoziierten Tumoren. Die Geschichte der Impfstoffentwicklung reicht weit zurück: Erste Berichte über Impfversuche mittels Inokulation stammen bereits aus dem 15. Jahrhundert aus China und Indien. Diese frühen Methoden ähnelten dem Prinzip des Lebendimpfstoffs, wie ihn Edward Jenner 1796 erfolgreich zur Bekämpfung von Kuhpocken einsetzte. Im Laufe der Zeit wurden proteinbasierte Totimpfstoffe entwickelt, oft ergänzt durch Adjuvanzien zur Verstärkung der Immunantwort. Ein weiteres bekanntes Prinzip ist der Polysaccharid-Impfstoff, der beispielsweise bei der Pneumokokkenimpfung zum Einsatz kommt. Doch mit der Einführung der mRNA-Impfstoffe hat eine völlig neue Ära der Impfstoffentwicklung begonnen, die durch wegweisende Neue Technologie geprägt ist und das Potenzial hat, die Medizin nachhaltig zu verändern.
Was ist ein mRNA-Impfstoff und wie funktioniert diese neue Technologie?
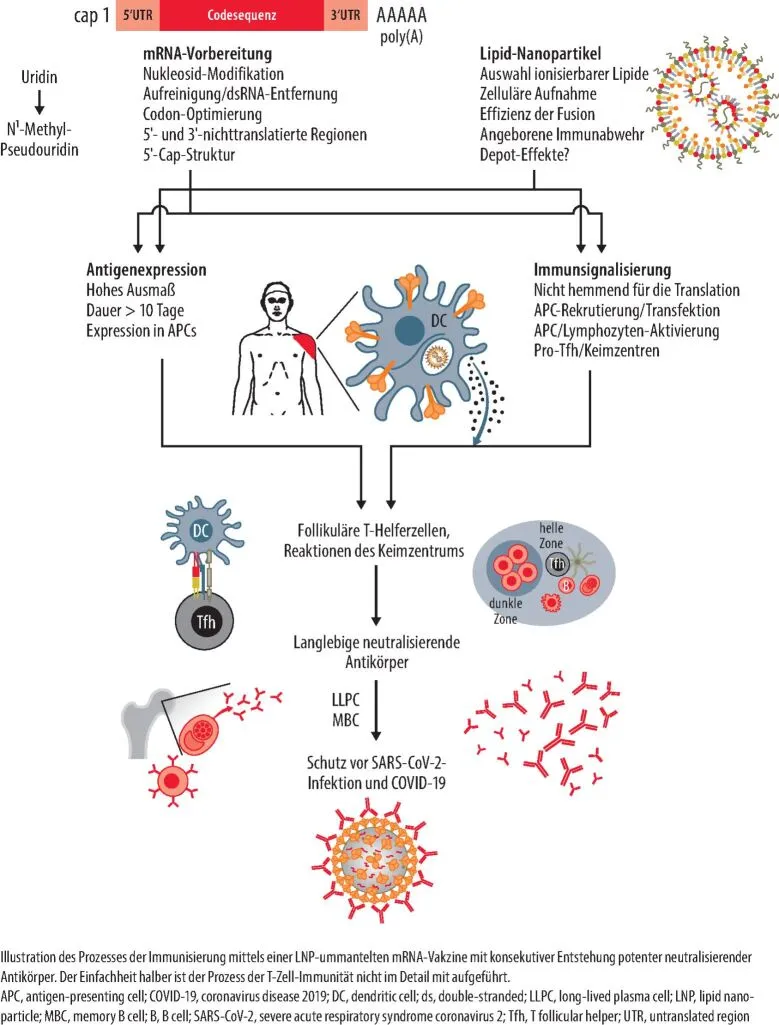
mRNA-Impfstoffe nutzen die Boten-Ribonukleinsäure (engl. messenger RNA, mRNA) als Informationsüberträger. Sie tragen den Bauplan für ein spezifisches Protein, das der Körper dann selbst herstellen kann. Dieser innovative Ansatz stellt eine neue Technologie dar, da er nicht direkt das Antigen injiziert, sondern dem Körper die Anleitung zur Produktion liefert. Freie, „nackte“ RNA ist im Körper extrem instabil und wird rasch durch spezifische Enzyme, sogenannte RNAsen, abgebaut. Um dies zu verhindern und die mRNA sicher in die Zielzelle zu transportieren, sind alle erfolgreich eingesetzten mRNA-Impfstoffe in sogenannte Lipidnanopartikel (LNPs) verpackt. Diese Lipidhülle macht die mRNA thermostabil und schützt sie vor vorzeitigem Abbau.
Durch Endozytose werden die LNPs mit der mRNA in die Zelle aufgenommen. Sobald dieser entscheidende Schritt gemeistert und die mRNA im Zytosol der Zielzelle angekommen ist, beginnt der zelluläre Translationsmechanismus mit der Produktion des vollständigen und voll funktionsfähigen Proteins. Die mRNA verbleibt dabei ausschließlich im Zytosol und gelangt niemals in den Zellkern. Es ist wichtig zu betonen, dass die mRNA auch nicht einfach in DNA – den Code unseres Erbguts – umgeschrieben werden kann, da die dafür notwendigen Enzyme fehlen. Dies bedeutet, dass die mRNA nicht in das menschliche Erbgut eingebaut werden kann. Die Sorge davor ist somit völlig unbegründet und widerspricht dem wissenschaftlichen Verständnis dieser neuen Technologie.
 graphic file with name 15006_2022_926_Fig2_HTML.jpg
graphic file with name 15006_2022_926_Fig2_HTML.jpg
Abbildung 1: Schematische Darstellung der Funktionsweise eines mRNA-Impfstoffs in der Zelle, verdeutlichend die Produktion des Zielproteins und die Aktivierung der Immunantwort durch diese innovative neue Technologie.
Wie wirkt ein mRNA-Impfstoff im Körper?
Das Ziel-Antigen, ein spezifisches Proteinmerkmal eines Virus, wird auf Basis der injizierten mRNA direkt in den Körperzellen produziert. Dies löst die gewünschte Immunreaktion aus. Das Antigen wird dabei so ausgewählt, dass es idealerweise bereits auf der Virusoberfläche erkennbar ist und nicht erst nach einer Infektion der Zellen freigesetzt wird. Dadurch kann die Infektion der Zellen bereits im Frühstadium verhindert werden. Im Falle des Impfstoffs gegen SARS-CoV-2 liefert die mRNA den Bauplan für das sogenannte Spike-Protein, ein zentrales Merkmal der Virusoberfläche.
Das Spike-Protein ist entscheidend für den Eintritt des Virus in die Wirtszelle. Es ist selbst nicht infektiös und stellt keine lebende, abgeschwächte Virusform dar. Nach der Impfung produzieren die Körperzellen das Spike-Protein an den Ribosomen. Dieses kann sowohl über Humane Leukozytenantigen (HLA)-Rezeptoren präsentiert als auch in die Blutbahn freigesetzt werden, wo es zu antigenpräsentierenden Zellen gelangt. Beide Wege führen zu einer sowohl humoralen (Antikörperproduktion) als auch einer zellulären Immunantwort durch Stimulation von T-Zellen.
Bei einem späteren Kontakt des Körpers mit SARS-CoV-2 wird das an der Oberflächenstruktur des Virus vorhandene „echte“ Spike-Protein schnell erkannt. Die zirkulierenden, gegen SARS-CoV-2-Spike gerichteten neutralisierenden Antikörper binden an das Spike-Protein und „neutralisieren“ es, wodurch das Virus nicht in die Zelle eindringen kann. Zusätzlich unterstützen spezifische T-Zellen das Immunsystem und können infizierte Zellen direkt eliminieren. Die Immunantwort nach einer mRNA-Impfung umfasst somit sowohl den Antikörper- als auch den T-Zell-vermittelten Arm des Immunsystems. Daher kann eine alleinige Bestimmung der Impfantikörper immer nur einen Teil der gesamten Immunantwort abbilden.
Da SARS-CoV-2 ein Virus mit hoher Mutationsfreudigkeit ist, kann sich auch die Zielstruktur der mRNA-Impfstoffe rasch ändern. Eine Infektion mit einer neuen Virusvariante kann dadurch weniger effektiv bekämpft werden. Dennoch bleibt in der Regel eine gewisse Grundimmunität bestehen, was die Anpassungsfähigkeit dieser neuen Technologie unterstreicht.
Vorteile und Limitationen der mRNA-Technologie gegenüber herkömmlichen Impfstoffen
Die mRNA-Technologie bietet eine Reihe signifikanter Vorteile gegenüber traditionellen Impfstoffentwicklungsprozessen und etabliert sich als wegweisende neue Technologie in der modernen Medizin.
Überlegene Produktionsgeschwindigkeit und Anpassungsfähigkeit
Bei herkömmlichen Impfstoffen dauert es oft sehr lange, bis eine gewünschte Vakzine einsatzbereit ist. Die Proteine, die als Antigene dienen sollen, müssen zunächst aus den Viren selbst gewonnen werden. Dies erfordert eine vorherige Anzucht der Viren, beispielsweise in Hühnereiern für Influenza-Impfstoffe – ein Faktor, der das allergene Potenzial solcher Impfstoffe erklärt. Auch die Aufreinigung der Virusbestandteile ist sehr zeitaufwendig. Bei neu auftretenden Virusvarianten muss dieser gesamte Prozess von Neuem begonnen werden.
mRNA-Impfstoffe hingegen lassen sich vergleichsweise einfach und in großer Menge aus der DNA-Sequenz des Ziel-Virusproteins herstellen. Hierfür sind nur sehr geringe Virusmengen oder lediglich die Gensequenz erforderlich. Der rasche und sichere Herstellungsprozess ist daher im Vergleich zu herkömmlichen Vakzinen deutlich kostengünstiger. Ein weiterer entscheidender Vorteil dieser neuen Technologie ist die schnelle Anpassungsfähigkeit: Als Antwort auf neue Virusmutationen kann der Impfstoff sehr zügig durch eine veränderte Gensequenz modifiziert und neu produziert werden.
Sicherheit und geringeres Allergenpotenzial
Die mRNA-Vakzinen sind Totimpfstoffe. Im Gegensatz zu Lebendimpfstoffen ist ihre Anwendung daher bei immunsupprimierten Patienten bedenkenlos möglich, ähnlich wie bei inaktivierten und Subunit-Impfstoffen. Ein weiterer entscheidender Vorteil liegt in den inhärenten adjuvanten, immunstimulierenden Eigenschaften der mRNA selbst. Die gleichzeitige Applikation von externen Adjuvanzien (wie Aluminiumsalzen, Öl-in-Wasser-Emulsionen oder 3-O-Desacyl-monophosphoryl Lipid A) ist daher nicht erforderlich. Während Adjuvanzien in Form von Restbestandteilen im Körper verbleiben können, werden die Komponenten eines mRNA-Impfstoffs rasch und vollständig abgebaut. Studien haben gezeigt, dass die für die COVID-19-Impfung verwendete mRNA eine ausgeprägte TLR7/8-vermittelte Typ-1-Interferon- und Interleukin-6-Antwort auslöst. Dies induziert eine robuste Proliferation von zytotoxischen T-Zellen (CTL), B-Zellen und natürlichen Killerzellen (NK), was eine effiziente antivirale Immunantwort ermöglicht.
Lagerung und spezifische Antigentypen als Herausforderungen
Ein gewisser Nachteil der mRNA-Technologie besteht darin, dass man grundsätzlich ausschließlich gegen Protein-Antigene immunisieren kann. Andere Zielstrukturen wie Polysaccharide können hier nicht als Zielantigen verwendet werden. Problematisch ist zudem die Notwendigkeit sehr niedriger Temperaturen für die Langzeitlagerung (-25 °C bis -15 °C bzw. -90 °C bis -60 °C, je nach Impfstoff). Dies stellt besonders in Regionen mit eingeschränkter Infrastruktur eine logistische Herausforderung dar. Es laufen jedoch bereits vielversprechende Studien zur Entwicklung von COVID-19-mRNA-Impfstoffen, die deutlich länger kühlschrankstabil sind, sowie zu einer möglichen lyophilisierten (gefriergetrockneten) Formulierung (wie BNT162b2). Diese Entwicklungen zeigen, dass auch die Limitationen der neuen Technologie aktiv angegangen und stetig verbessert werden.
Die Zukunft der medizinischen Innovation: Weit mehr als nur Impfstoffe
Die mRNA-Technologie steht exemplarisch für eine dynamische Entwicklung im Bereich der neuen Technologie, die weit über die aktuelle Pandemie hinausreicht. Ihr Potenzial, globale Gesundheitsherausforderungen zu meistern und die Medizin neu zu gestalten, ist immens.
Globale Verfügbarkeit und lokale Produktion
Um globale infektiologische Probleme wie die COVID-19-Pandemie effektiv zu bekämpfen, sind modulare und mobile Produktionsstätten für mRNA-Impfstoffe von großem Vorteil. Damit könnte potenziell in allen Ländern der Welt Impfstoff lokal produziert und appliziert werden, was die Unabhängigkeit und Reaktionsfähigkeit deutlich erhöht. Eine wegweisende Initiative in diese Richtung stellen die sogenannten BioNTainer dar, die beispielsweise in afrikanischen Ländern eine lokale Produktionsstätte für mRNA-Impfstoffe ermöglichen sollen. Der BioNTainer ist so konzipiert, dass er eine Reihe von mRNA-basierten Impfstoffen herstellen kann, die auf die spezifischen Bedürfnisse des jeweiligen Landes zugeschnitten werden können. Solche Initiativen erfordern nicht nur wissenschaftliche Exzellenz, sondern auch koordinierte politische Bildung und ein tiefes Verständnis der politische Prozesse, um die Akzeptanz und Implementierung dieser neuen Technologie weltweit zu gewährleisten.
Von Infektionskrankheiten bis zur Krebstherapie
Die Anwendung der mRNA-Technologie ist nicht erst seit der Entwicklung der COVID-19-Impfstoffe ein Forschungsfeld. Erste Nukleinsäure-basierte Vakzine wurden bereits Anfang der 1990er-Jahre erfolgreich in Tierversuchen eingesetzt. Schon 2008 gab es erste Erfolge bei der Entwicklung eines mRNA-Impfstoffs gegen Melanome. Tatsächlich richten sich heute über 50% der mRNA-Impfstoffe in der Entwicklungspipeline gegen verschiedene Krebserkrankungen. Zukünftig werden weitere relevante Infektionserkrankungen Ziel der mRNA-Impfstoffentwicklung sein. In der Entwicklungspipeline finden sich unter anderem Impfstoffe gegen Dengue, Ebola, Malaria, das Marburg- und Lassafiebervirus sowie Tuberkulose, HIV, HSV-2 und Influenza. Die Weiterentwicklung dieser Forschungsbereiche erfordert kontinuierlich bildungspolitische Weichenstellungen und die Förderung von Ausbildung und Beruf in naturwissenschaftlichen und medizinischen Fachrichtungen.
 graphic file with name 15006_2022_926_Fig4_HTML.jpg
graphic file with name 15006_2022_926_Fig4_HTML.jpg
Abbildung 2: Übersicht über eine Auswahl an mRNA-Impfstoffen in der Entwicklungspipeline, die das breite Anwendungsspektrum dieser neuen Technologie verdeutlicht.
Fortschritte bei der “self-amplifying mRNA”
Ein vielversprechender Gegenstand aktueller Forschung ist zudem die sogenannte „self-amplifying mRNA“. Diese Impfstoffe enthalten nicht nur die mRNA für das Zielprotein, sondern auch eine Replikase, die ohne Hilfe des Ribosoms die mRNA selbst amplifiziert. Dies ermöglicht eine geringere Dosis des Impfstoffs bei gleichbleibend starker Immunantwort und könnte die Effizienz und Verfügbarkeit weiter steigern. Die mRNA-Technologie hat zweifellos eine Zeitenwende in der Medizin eingeleitet und die kommenden Jahre werden vermutlich weitere bahnbrechende Erfolge zeigen. Das Verständnis der historische und gesellschaftliche Dimensionen des wissenschaftlichen Fortschritts ist dabei unerlässlich, um die Akzeptanz und den verantwortungsvollen Einsatz jeder neue Technologie sicherzustellen. Es bleibt spannend zu beobachten, welche weiteren Innovationen diese bahnbrechende Entwicklung noch hervorbringen wird.
Fazit für die Praxis
- Die mRNA-Impfstoff-Technologie ist eine sichere und anpassungsfähige neue Technologie im Vergleich zu herkömmlichen Impfstoffen und hat das Potenzial, die Prävention und Therapie von Krankheiten zu revolutionieren.
- Eine Immunisierung ist mit dieser Technologie grundsätzlich nur gegen Proteinantigene möglich, wobei die Forschung an erweiterten Anwendungen stetig voranschreitet.
- Aufgrund der zahlreichen Vorteile – wie relativ schnelle und sichere Entwicklung, rasche Anpassungsfähigkeit an neue Virusvarianten und die fehlende Notwendigkeit von Adjuvanzien – eröffnen sich in Zukunft sowohl in der Infektiologie als auch bei anderen Erkrankungen (z. B. Krebstherapie, Diabetes) viele neue und vielversprechende Möglichkeiten. Die mRNA-Technologie ist ein Paradebeispiel für den zukunftsweisenden Fortschritt durch neue Technologie in der modernen Medizin.
Autoren:
PD Dr. med. Ulrich von Both
Abteilung Pädiatrische Infektiologie, Kinderklinik und Kinderpoliklinik im Dr. von Haunerschen Kinderspital, LMU Klinikum, Ludwig-Maximilians-Universität Lindwurmstr. 4, D-80337 München, ulrich.von.both@med.lmu.de
Dr. med. Lena Teresa Birzele
Abteilung Pädiatrische Infektiologie, Kinderklinik und Kinderpoliklinik im Dr. von Haunerschen Kinderspital, LMU Klinikum, München
Supplementary Information
15006_2022_926_MOESM1_ESM.pdf (1.4MB, pdf)
Interessenkonflikt
Die Autoren erklären, dass sie keine Interessenkonflikte anzugeben haben.
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
15006_2022_926_MOESM1_ESM.pdf (1.4MB, pdf)
